题目内容
【题目】水是生命的源泉,也是不可缺少的资源。
(1)某矿泉水的主要矿物质成分及含量如下表:
成分 | Ca | K | Zn | F |
含量(mg/L) | 20 | 3 | 0.06 | 0.02 |
这里Ca、K、Zn、F是指________ (填“单质、元素、分子或原子”)。
(2)水污染日益严重,水资源的保护和合理利用已受到人们的普遍关注。请参与讨论下列有关问题:
(Ⅰ)自来水、蒸馏水、海水中属于纯净物的是___________。
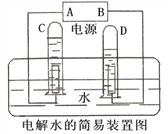
(Ⅱ)某学校饮水处可以将自来水净化为饮用水,其中处理步骤如下图所示:

①对应的作用是_________(填字母序号,下同),③对应的作用是_______。
A. 杀菌消毒 B.吸附杂质 C.沉淀过滤 D.蒸馏
【答案】 元素 蒸馏水 B A
【解析】(1)某矿泉水中的“Ca、K、F ”等不是以单质、分子、原子等形式存在,这里的“Ca、K、Zn、F”所指是元素;(2)(Ⅰ)自来水、蒸馏水、海水中属于纯净物的是蒸馏水;(Ⅱ)活性炭具有吸附性,能吸附水中色素及有异味的杂质,因此在自来水的净化中活性炭的作用为吸附作用;紫外线有消毒杀菌的作用。

【题目】水是我们熟悉的物质。
①为了测定水的组成,进行如下探究:
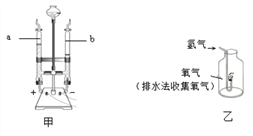
甲方案:电解水时玻璃管内的现象是____________;b管内生成的气体是______________;检验a管内产生气体的方法是___________。生成气体的体积比是___________,该实验说明水是由氢、氧元素组成的理论依据是__________;
电解水时,常加入少量氢氧化钠使电解水反应容易进行,而氢氧化钠本身的质量和化学性质不发生变化。若水电解装置中盛有一定量的氢氧化钠溶液,通电一段时间后,产生了16g氧气,管内溶液中氢氧化钠的质量分数由 2.7%变为3.0%。试计算
Ⅰ.参加反应的水的物质的量____________mol(根据化学方程式列式计算)。
Ⅱ.电解前氢氧化钠溶液的质量为________________g。
乙方案:该方案的实验目的是____________________,氢气在氧气中燃烧,反应的化学方程式是_________________,现象__________;该实验能否达到实验目的,并阐述理由___________。
②下表是KNO3 、NaCl在不同温度下的部分溶解度数据。
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
KNO3 | 13.3 | 20.9 | 32.0 | 45.8 | 64.0 | 85.5 | 110.0 | 138.0 | 169.0 | 202.0 | 246.0 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | 39.0 | 39.8 |
Ⅰ. 以上两种物质溶解度的变化受温度影响较小的是___________。
Ⅱ. 在40℃时,将40gKNO3溶解在50g水中,形成溶液的质量是_______g。若升温至60℃,形成的溶液为________(填“饱和”或“不饱和”)溶液,该溶液的溶质质量分数为_______。
Ⅲ.根据表中数据,找出60.0g水能够溶解66.0g KNO3的温度范围是___________。
Ⅳ. 固体KNO3中混有少量NaCl,欲提纯KNO3所需的实验步骤为________。
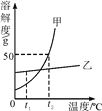
Ⅴ.气体在水中的溶解度也有一定的变化规律。下图为不同温度下,某气体的溶解度与温度的关系。
图中P1与P2表示气压,则P1与P2的关系是________。
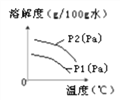
A.P1>P2
B.P1=P2
C.P1<P2
D.无法确定