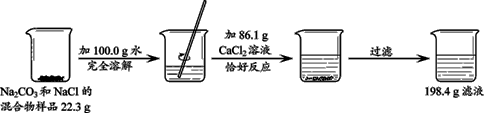题目内容
(5分)某化工厂排放的废水中只含有盐酸和MgCl2两种物质。小明同学向采集来的62.8 g废水样品中,慢慢加入20%的NaOH溶液至恰好完全反应时,消耗NaOH溶液60g。将生成的沉淀物过滤出,经水洗、干燥后称重为5.8g。
⑴写出向废水中加入NaOH溶液发生反应的化学方程式:
⑵请求出上述废水样品完全反应后的溶液里溶质的质量分数(要有计算过程)
【相对分子质量:MgCl2-95、NaOH-40、HCl-36.5、NaCl-58.5、Mg(OH)2-58、H2O-18】
⑴写出向废水中加入NaOH溶液发生反应的化学方程式:
⑵请求出上述废水样品完全反应后的溶液里溶质的质量分数(要有计算过程)
【相对分子质量:MgCl2-95、NaOH-40、HCl-36.5、NaCl-58.5、Mg(OH)2-58、H2O-18】
(1)HCl + NaOH ="==" NaCl + H2O MgCl2 + 2NaOH ="==" 2NaCl + Mg(OH)2↓(2分)
(2)15% (3分)
(2)15% (3分)
:(1)盐酸与氢氧化钠反应的反应物是盐酸和氢氧化钠,生成物是氯化钠和水;氯化镁与氢氧化钠反应的反应物是氯化镁和氢氧化钠,生成物是氯化钠和氢氧化镁,氢氧化镁要标上沉淀符号,用观察法配平,所以方程式分别为:HCl+NaOH═NaCl+H2O、MgCl2+2NaOH═2NaCl+Mg(OH)2↓
(2)解:参加反应的氢氧化钠的质量为60g×20%=12g
根据方程式可知溶质都是氯化钠,并且消耗氢氧化钠与生成的氯化钠的分子个数比都是1:1,所以根据关系式法可求出氯化钠,设氯化钠质量为X:
NaOH-------NaCl
40 58.5
12g X
根据:
=
解得X=17.55g
反应后总溶液质量为:62.8g+60g-5.8g=117g所以废水样品完全反应后的溶液里溶质的质量分数为:
× 100%=15%.
故答案为:(1)HCl+NaOH═NaCl+H2O、MgCl2+2NaOH═2NaCl+Mg(OH)2↓;(2)15%.
(2)解:参加反应的氢氧化钠的质量为60g×20%=12g
根据方程式可知溶质都是氯化钠,并且消耗氢氧化钠与生成的氯化钠的分子个数比都是1:1,所以根据关系式法可求出氯化钠,设氯化钠质量为X:
NaOH-------NaCl
40 58.5
12g X
根据:
| 40 |
| 58.5 |
| 12g |
| X |
反应后总溶液质量为:62.8g+60g-5.8g=117g所以废水样品完全反应后的溶液里溶质的质量分数为:
| 17.55g |
| 117g |
故答案为:(1)HCl+NaOH═NaCl+H2O、MgCl2+2NaOH═2NaCl+Mg(OH)2↓;(2)15%.

练习册系列答案
相关题目
 CaCO3↓ + 2NaCl
CaCO3↓ + 2NaCl