题目内容
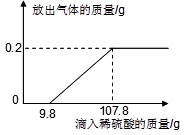
在烧杯中加入2.14g久置的铝箔,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如右图所示。请回答下列问题:
(1)产生氢气 g,刚开始滴加稀硫酸没有氢气放出的原因是 。
(2)所滴加的稀硫酸中溶质的质量分数。
(3)铝箔中铝元素的质量。
(1)产生氢气 g,刚开始滴加稀硫酸没有氢气放出的原因是 。
(2)所滴加的稀硫酸中溶质的质量分数。
(3)铝箔中铝元素的质量。

(1)0.2 盐酸与氧化铝反应 (2)10% (3)92.52%
由放出气体的质量与所加稀硫酸质量的关系图可以看出生成的氢气的质量为0.2g,开始与酸反应的是氧化铝。
设参加反应的铝的质量为x, 所滴加的稀硫酸中溶质的质量分数为y,则
2Al+3H2SO4=Al2(SO4)3+3H2↑
54 294 6
x (107.8g-9.8g)y 0.2g
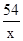 =
=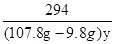 =
=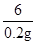 x=1.8g y=10%
x=1.8g y=10%
答:(1)产生氢气的质量为0.2g,(2)所滴加的稀硫酸中溶质的质量分数为10%,(3)铝箔中铝元素的质量为1.8g。
设参加反应的铝的质量为x, 所滴加的稀硫酸中溶质的质量分数为y,则
2Al+3H2SO4=Al2(SO4)3+3H2↑
54 294 6
x (107.8g-9.8g)y 0.2g
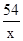 =
=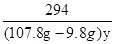 =
=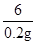 x=1.8g y=10%
x=1.8g y=10%答:(1)产生氢气的质量为0.2g,(2)所滴加的稀硫酸中溶质的质量分数为10%,(3)铝箔中铝元素的质量为1.8g。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

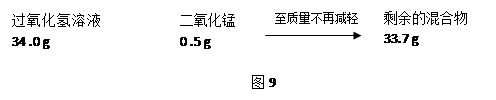
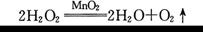
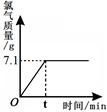
 Cl2↑+ H2↑+ 2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠恰好完全反应时,得到51.2 g溶液,生成氯气的质量与时间的关系如图所示。请计算:
Cl2↑+ H2↑+ 2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠恰好完全反应时,得到51.2 g溶液,生成氯气的质量与时间的关系如图所示。请计算: