题目内容
【题目】(5分)KNO3和NaCl在不同温度时的溶解度如下表所示。请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |||||||||
溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | ||||||||
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | |||||||||
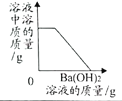
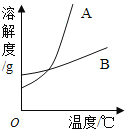
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如图所示:
图中能表示KNO3溶解度曲线的是 (填“A”或“B”)
(2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解 度,则温度的范围是 ;
(3)某兴趣小组做了一下实验:
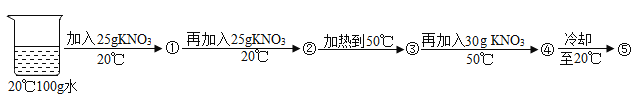
上述实验过程中得到的溶液一定属于不饱和溶液的是 (填数字序号),将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体 g;
(4)硝酸钾中含有少量氯化钠时,可通过 (填“蒸发结晶”或“降温结晶”)的方法提纯。
【答案】(1)A(2)20℃至30℃时
(3)①③④ 59.1g
(4)降温结晶
【解析】
试题分析:(1)根据表中数据可知:在0℃时硝酸钾的溶解度小于氯化钠的溶解度;而根据图像可知:在0℃时A的溶解度小于B的溶解度;所以A表示硝酸钾的溶解度曲线。
(2)根据表中数据可知:在20℃时硝酸钾的溶解度小于氯化钠的溶解度;在30℃时硝酸钾的溶解度大于氯化钠的溶解度;所以二者在温度为20℃至30℃时溶解度相等。
(3)在20℃时硝酸钾的溶解度为31.6g。即在20℃温度下,硝酸钾在100g水里达到饱和状态时所溶解的质量为31.6g。因此题目中向100g水里25g硝酸钾时,所得溶液①为不饱和溶液;向溶液①再加25g硝酸钾时,硝酸钾的总质量为50g;而20℃时硝酸钾最多溶解31.6g,此时溶液②为饱和溶液。溶液②加热至50℃时,此时硝酸钾的溶解度为85.5g。此时硝酸钾的总质量为50g,所以溶液③为不饱和溶液。再加入30g硝酸钾,硝酸钾的总质量为80g,所以溶液④仍为不饱和溶液。溶液④冷却至20℃,得到的溶液⑤中硝酸钾的总质量为80g,硝酸钾的溶解度为31.6g。此时溶液为饱和溶液。所以溶液①③④为不饱和溶液。 将溶液⑤继续冷却至10℃,硝酸钾的溶解度为20.9g,此时硝酸钾的总质量为80g。所以析出固体的质量为:80g—20.9g=59.1g
(4)当温度变化时,硝酸钾的溶解度变化较大,而氯化钠的溶解度变化较小。所以可通过降温结晶的方法提纯硝酸钾。

 名校课堂系列答案
名校课堂系列答案【题目】化学研究性学习小组同学取 10g 石灰石样品,用足量的稀盐酸测定石灰石中碳酸钙的质量分数(假设石灰石中杂质不与盐酸反应)。测量 5 分钟内生成 CO2 质量的数据如表:
时间/分钟 | 1 | 2 | 3 | 4 | 5 |
生成 CO2 的质量/g | 1.5 | 2.5 | 3.0 | 3.3 | 3.3 |
请回答下列问题:
(1)石灰石中的 CaCO3 完全反应时,生成二氧化碳气体的物质的量为_____mol。
(2)该石灰石中 CaCO3 的质量分数是多少?(根据化学方程式列式计算)_____。
(3)请根据表中数据分析,你能发现数据背后的化学反应规律是_____。
【题目】下列图像分别表示4个实验的过程中,其中图像与对应实验相符合的是
|
|
|
|
A.向一定质量稀H2SO4中加入Ba(OH)2至恰好中和 | B.将一定质量的不饱和KNO3溶液恒温蒸发至有晶体析出 | C.向等质量的金属Fe和Zn中分别加入等浓度的稀盐酸 | D.CuO和C的固体混合物在高温下反应 |
A. AB. BC. CD. D
【题目】下列实验操作和现象能得出相应结论的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向收集满CO2的软塑料瓶中加入约 | 塑料瓶变瘪 | CO2能与食盐反应 |
B | 点燃从导管放出的某气体,在火焰上方罩一个冷而干燥的烧杯 | 烧杯内壁有无色液滴产生 | 被点燃的气体一定是H2 |
C | 50℃时,将19g KCl固体加入50g蒸馏水中,完全溶解后缓慢降温 | 降温至20℃时开始有晶体析出 | 20℃时,KCl的溶解度为19g |
D | 将白磷浸没在热水中,再向热水中的白磷通氧气 | 通氧气前白磷不燃烧,通氧气后白磷燃烧 | 氧气是可燃物燃烧的条件之一 |
A. AB. BC. CD. D