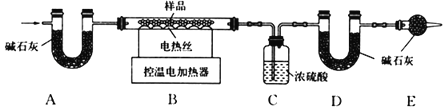
题目内容
【题目】化学研究性学习小组同学取 10g 石灰石样品,用足量的稀盐酸测定石灰石中碳酸钙的质量分数(假设石灰石中杂质不与盐酸反应)。测量 5 分钟内生成 CO2 质量的数据如表:
时间/分钟 | 1 | 2 | 3 | 4 | 5 |
生成 CO2 的质量/g | 1.5 | 2.5 | 3.0 | 3.3 | 3.3 |
请回答下列问题:
(1)石灰石中的 CaCO3 完全反应时,生成二氧化碳气体的物质的量为_____mol。
(2)该石灰石中 CaCO3 的质量分数是多少?(根据化学方程式列式计算)_____。
(3)请根据表中数据分析,你能发现数据背后的化学反应规律是_____。
【答案】0.075 75% 反应物浓度减小,反应速率减慢
【解析】
根据表中数据和对应的化学方程式求算和分析。
解:(1)生成二氧化碳的质量为3.3g,其物质的量为![]() =0.075mol;
=0.075mol;
(2)设该石灰石中 CaCO3 的质量分数为x,
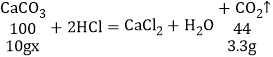
![]()
x=75%;
(3)根据表中数据可以看出:反应物浓度减小,反应速率减慢。

 阅读快车系列答案
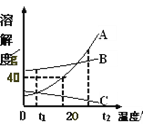
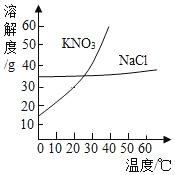
阅读快车系列答案【题目】(5分)KNO3和NaCl在不同温度时的溶解度如下表所示。请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |||||||||
溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | ||||||||
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | |||||||||
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如图所示:
图中能表示KNO3溶解度曲线的是 (填“A”或“B”)
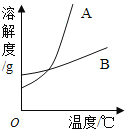
(2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解 度,则温度的范围是 ;
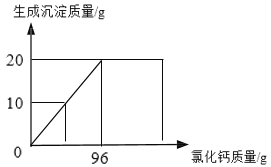
(3)某兴趣小组做了一下实验:
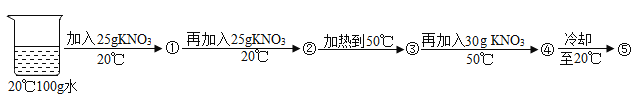
上述实验过程中得到的溶液一定属于不饱和溶液的是 (填数字序号),将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体 g;
(4)硝酸钾中含有少量氯化钠时,可通过 (填“蒸发结晶”或“降温结晶”)的方法提纯。
【题目】小明同学把黑色的氧化铜粉末与黑色的木炭粉均匀混合后,放入试管内加热到高温,充分反应后,试管内除有红色物质产生外,仍有黑色固体残留.
[提出问题]这黑色残余固体是什么物质?
[猜想与假设]
(1)残余固体是碳;
(2)残余固体是_____;
(3)残余固体是碳与氧化铜的混合物.
[分析与实验]:
(1)以上实验发生反应的化学方程式为_____
(2)小亮同学认为猜想(3)可以排除,他的理由是_____
(3)小明设计如下简单的实验进行,请你代小明填写下表
实验过程 | 实验现象 | 结论 |
取少量黑色固体加入 足量的稀硫酸 | ①_____ | 猜想(1)正确 |
②_____ | 猜想(2)正确 |
(4)小明想把铜粉中的木炭除去获得纯净的铜粉;于是他把该混合物放置在空气中灼烧.请问他的实验能否成功,为什么?_____.