题目内容
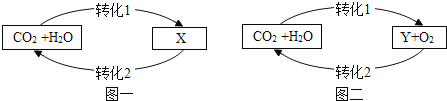
【题目】图中A~J是初中化学常见的物质,且分别由H、C、O、S、Cl、Na、Ca、Cu、Zn中一种或几种元素组成。A、B、E、G均属于单质;C、D、H均由两种元素组成,C中两种元素质量之比为1:4;F、I、J均由三种元素组成,I俗称为纯碱。“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。
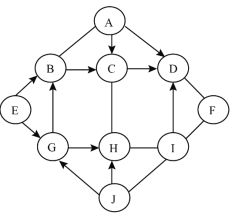
(1)写出A的名称:_____,H的化学式:_____。
(2)写出G→B反应的化学方程式:_____。
(3)写出F与I反应的化学方程式:_____。
【答案】氧气 HCl H2+CuO![]() Cu+H2O Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Cu+H2O Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
【解析】
根据“C含有两种元素且元素质量比为1:4”和“I俗称纯碱”可知,C为CuO,I为Na2CO3。H含有两种元素,既可以与CuO反应,又可以与Na2CO3反应,可知H为HCl。G为能生成HCl的单质,因此为H2。单质B既可以生成CuO,又可以被H2反应生成,可得为Cu。单质A可以与Cu反应,因此必然为O2。F含有三种元素,且可与Na2CO3反应,结合题目所给元素种类,推测F为Ca(OH)2。根据D可以被O2和CuO生成,且可与Ca(OH)2反应,可知D为CO2。单质E可以生成H2和Cu,推出必为活泼金属,按照题目所给元素种类,推出为Zn。J含有三种元素,能够生成H2和HCl,并能与Na2CO3反应。根据Na2CO3的化学性质,结合反应关系,可知J为H2SO4。
(1)A的名称:氧气,H的化学式:HCl。
(2)写出G→B反应的化学方程式:H2+CuO![]() Cu+H2O。
Cu+H2O。
(3)写出F与I反应的化学方程式:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。

【题目】(5分)KNO3和NaCl在不同温度时的溶解度如下表所示。请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |||||||||
溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | ||||||||
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | |||||||||
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如图所示:
图中能表示KNO3溶解度曲线的是 (填“A”或“B”)
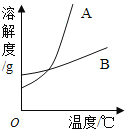
(2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解 度,则温度的范围是 ;
(3)某兴趣小组做了一下实验:
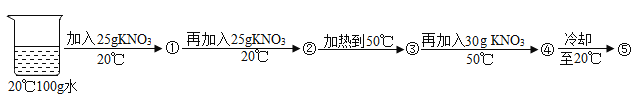
上述实验过程中得到的溶液一定属于不饱和溶液的是 (填数字序号),将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体 g;
(4)硝酸钾中含有少量氯化钠时,可通过 (填“蒸发结晶”或“降温结晶”)的方法提纯。
【题目】小明同学把黑色的氧化铜粉末与黑色的木炭粉均匀混合后,放入试管内加热到高温,充分反应后,试管内除有红色物质产生外,仍有黑色固体残留.
[提出问题]这黑色残余固体是什么物质?
[猜想与假设]
(1)残余固体是碳;
(2)残余固体是_____;
(3)残余固体是碳与氧化铜的混合物.
[分析与实验]:
(1)以上实验发生反应的化学方程式为_____
(2)小亮同学认为猜想(3)可以排除,他的理由是_____
(3)小明设计如下简单的实验进行,请你代小明填写下表
实验过程 | 实验现象 | 结论 |
取少量黑色固体加入 足量的稀硫酸 | ①_____ | 猜想(1)正确 |
②_____ | 猜想(2)正确 |
(4)小明想把铜粉中的木炭除去获得纯净的铜粉;于是他把该混合物放置在空气中灼烧.请问他的实验能否成功,为什么?_____.
【题目】用珍珠加工成的“珍珠粉”是一种名贵中药材、保健品,可近年来市场上出现了一些假冒的“珍珠粉”,仅用肉眼观察难辨真假.为了向消费者提供鉴别方法,须找出真假“珍珠粉”理化性质上的差异.为此,某工商局提供了真、假“珍珠粉”样品和有关真假珍珠粉的资料如表:
品种 | 外观 | 成分 | 制作过程 |
真珍珠粉 | 白色无味粉末 | 主要为碳酸钙,可能含少量碳酸镁、壳角蛋白等. | 直接将珍珠磨成粉末. |
假珍珠粉 | 白色无味粉末 | 贝壳粉(主要成分为CaCO3),可能含少量碳酸镁并掺有少量淀粉. | 将贝壳漂白(漂白过程中用到过NaOH),然后磨成粉末. |
其中,真珍珠粉中的壳角蛋白(蛋白质的一种)不溶于水,加入浓硝酸加热后会变黄色.某研究性学习小组对提供的真假珍珠粉进行了如下探究.
(探究一)对真假珍珠粉的初步鉴定:
(1)真、假珍珠粉均属于_____(“纯净物”或“混合物”).取少量珍珠粉样品于试管中,加入_____并加热,若观察到变黄色,则该样品是真珍珠粉.
(2)另取少量市售廉价珍珠粉于试管中,加入足量水振荡后静置,将上层清液分别倒入2支试管中,向一支试管中滴加_____,混合液变成蓝色,说明其中掺有淀粉;再向另一支试管中加入1~2滴_____,溶液变成微红色,说明在漂白贝壳的过程中用到过氢氧化钠,使溶液呈碱性.
(探究二)测定市售珍珠粉中碳酸钙的质量分数:
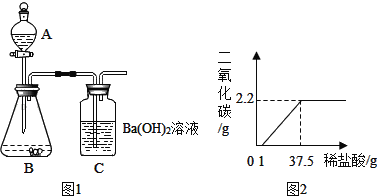
步骤Ⅰ:连接仪器组成如图1所示实验装置.某学生堵住C末端玻璃导管口,在A中装入少量水并取下上部塞子,打开玻璃活塞,A中水不能全部滴下,你认为该装置是否漏气?_____(填“漏气”或“不漏气”)
步骤Ⅱ:准确称取5.00g珍珠粉样品装入仪器B中,在A中装入一定浓度的稀盐酸.
步骤Ⅲ:向B中珍珠粉样品中滴加足量的稀盐酸.在仪器B、C中可观察到的现象分别为_____、_____.
步骤Ⅳ:完全反应后C中的混合液经_____、_____、干燥,称得白色固体的质量为9.85g(不考虑装置中原有空气及装置外空气的影响),由此求得珍珠粉样品中碳酸钙的质量分数为100%.
(实验反思)这个测定结果令研究小组的同学们感到难以理解,经过讨论分析,大家认为可能的原因是_____.(填数字序号)
①样品中含有碳酸镁 ②盐酸未滴加足量
③CO2气流速度太快导致未被Ba(OH)2完全吸收 ④装置B中水蒸气、HCl等进入装置C中
(拓展延伸)同学们根据测定数据计算出样品中碳酸根离子的质量分数为_____%.
有同学提出在探究二中不需要装置C,只要用电子天平准确称量装置A、B反应前后的总质量,也可以求得珍珠粉样品中碳酸根离子的质量分数.你认为这样求得的碳酸根离子的质量分数与上面所得数值相比,将会_____(填“不变”、“偏大”或“偏小”).后来,同学们经过精确测定,得到所加稀盐酸与产生的二氧化碳气体质量关系如图2所示.
(分析讨论)
(1)在加入稀盐酸的过程中,开始没有气体产生,是因为固体样品中还含有少量_____(填“碳酸镁”或“氢氧化钠”)的缘故.
(2)根据图示,求出所用稀盐酸的溶质质量分数____?(需有计算过程)