题目内容
【题目】镍粉常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。
I、【镍粉制备】:
工业用电解镍新液(主要含NiSO4、NiCl2)制备碱式碳酸镍晶体xNiCO3·yNi(OH)2·zH2O,并利用其制备镍粉的流程如下:
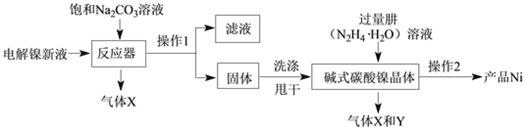
(1)反应器中的一个重要反应为3NiSO4 + 3Na2CO3 + 2H2O = NiCO3·2Ni(OH)2 +3Na2SO4 + 2X,X的化学式为______。
(2)物料在反应器中反应时需要控制反应条件。
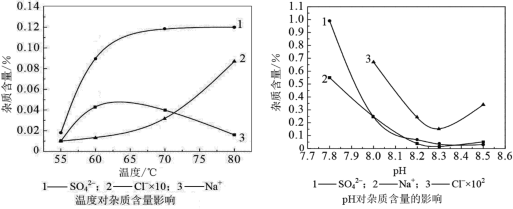
分析下图,反应器中最适合的温度及pH分别为______℃、______。
(3)生产中,pH逐渐增加,生成Ni(OH)2含量也相对增加,则生成的碱式碳酸镍晶体中,镍的含量将______(填“升高”、“降低”或“不变”)。
(4)操作1的名称是_______________,实验室完成此操作,需要的玻璃仪器是烧杯、玻璃棒及_________,其中玻璃棒的作用是_____。
(5)固体洗涤时,需用纯水洗涤,检验其洗涤干净的试剂是______。
(6)气体Y是空气中含量最多的气体,其是______(填名称)。
(7)操作2含过滤、水洗、95%酒精浸泡、晾干等操作,其中用95%酒精浸泡的目的是______。
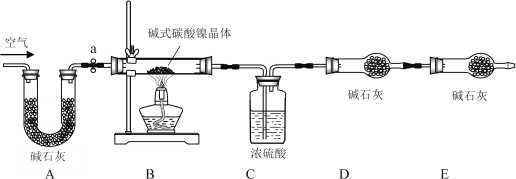
II、【测定碱式碳酸镍晶体的组成】:为测定碱式碳酸镍晶体(xNiCO3·yNi(OH)2·zH2O)组成,某小组设计了如下实验方案及装置:
【资料卡片】:
①碱式碳酸镍晶体受热会完全分解生成NiO、CO2及H2O。
②400℃左右,NiO会氧化生成Ni2O3。
③碱石灰是NaOH及CaO的混合物,可以吸收CO2和H2O。
【实验步骤】:
①______;②准确称取3.77g xNiCO3·yNi(OH)2·zH2O放在B装置中,连接仪器;③打开弹簧夹a,鼓入一段时间空气,称量装置C、D的质量;④关闭弹簧夹a,加热装置B至装置C中导管末端无气泡冒出;⑤打开弹簧夹a,______;⑥准确称量装置C、D的质量;⑦根据数据进行计算(相关数据如表)。
装置C / g | 装置D / g | 装置E / g | |
加热前 | 200.00 | 180.00 | 180.00 |
加热后 | 201.08 | 180.44 | 180.00 |
【实验分析及数据处理】:
(8)完善实验步骤中的填空:①______;⑤______。
(9)计算xNiCO3·yNi(OH)2·zH2O中x:y:z的值______。
(10)左侧通空气的目的是______、______。
【实验反思】:
(11)实验结束后,称得装置B中残留固体质量为2.33g。请通过计算确定残留固体的组成及各成分的质量(写出计算过程,精确到小数点后两位)_____。
【答案】 CO2 55 8.3 升高 过滤 漏斗 引流 BaCl2溶液或Ba(NO3)2溶液或Ba(OH) 2溶液 氮气 便于快速晾干 检查装置气密性 缓缓通空气一段时间 1:2:4 排尽装置中原有的CO2和水蒸气 将装置B中的CO2和水蒸气完全排出 残留固体为NiO和Ni2O3的混合物,剩余NiO质量为1.5g,生成Ni2O3 0.83g
【解析】I、(1)根据质量守恒定律反应,前后原子的总类和数目不变,
3NiSO4 + 3Na2CO3 + 2H2O = NiCO3·2Ni(OH)2 +3Na2SO4 + 2X,
反应前:Ni:3 反应后:Ni:3
S:3 S:3
O:23 O:17
H:4 H:4
C:3 C:1
所以X为:CO2
(2)反应器中杂质的含量越低越好,所以最适合的温度为55,最适合的pH为8.3;
(3)在NiCO3中镍的含量小于Ni(OH)2中镍的含量,生产中,pH逐渐增加,生成Ni(OH)2含量也相对增加,NiCO3的含量相对减小,则生成的碱式碳酸镍晶体中,镍的含量将升高。
(4)操作1将固体和液体分开,所以操作1为过滤,过滤过程中需要的玻璃仪器是烧杯、玻璃棒及漏斗,玻璃棒起到引流的作用;
(5)洗涤的目的是将碱式碳酸镍晶体表面的硫酸钠溶液等除去,检验其洗涤的是否干净,即检查是否有硫酸根离子,可加入BaCl2溶液或Ba(NO3)2溶液或Ba(OH) 2溶液,观察是否生成不溶于硝酸的沉淀;
(6)空气中含量最多的气体是氮气;
(7)用95%酒精浸泡的目的是使固体表面的水分分散到酒精中,便于固体快速晾干;
II、(8)做有关气体的制取和性质实验前,应先检查装置的气密性,加热后,为了将碱式碳酸镍晶体受热会完全分解生成的CO2及H2O完全被装置C、D吸收,缓缓通一段时间除去水分和二氧化碳的空气;
(9)装置C增加的质量(1.08g)为生成水的质量,装置D增加的质量(0.44g)为生成二氧化碳的质量;所以NiO的质量为3.77g-1.08g-0.44g=2.25g
xNiCO3·yNi(OH)2·zH2O![]() (x+y)NiO+xCO2↑+(y+z)H2O
(x+y)NiO+xCO2↑+(y+z)H2O
75(x+y) 44x 18(y+z)
2.25g 0.44g 1.08g
所以![]() ,
, ![]() ,
, ![]() ,
,
解得:x:y:z=1:2:4
(10)实验开始前左侧通空气的目的是排尽装置中原有的CO2和水蒸气;实验完毕时左侧通空气的目的是将装置B中的CO2和水蒸气完全排出 ;
(11)NiCO3·2Ni(OH)2 ·4H2O ~ 3NiO ~ 3Ni ~ 3O
377 225 177 48
3.77g 2.25g 1.77g 0.48g
∵ 装置B中残留固体质量为2.33g
∴ 残留固体中O元素质量为2.33g – 1.77g = 0.56g ,大于0.48g
残留固体中Ni、O元素质量比为1.77g:0.56g = 177:56
而NiO及Ni2O3中Ni、O元素质量比分别为177:48、177:72,故残留固体为NiO和Ni2O3的混合物。
残留固体质量增加2.33g – 2.25g = 0.08g,是和NiO反应的O2质量
设与氧气反应的NiO质量为x 生成的Ni2O3质量为y
4 NiO + O2![]() 2Ni2O3
2Ni2O3
300 32 332
x 0.08g y
x=0.75g y=0.83g
剩余NiO质量为2.25g – 0.75g = 1.5g,生成Ni2O3 0.83g。

【题目】下列实验方案的设计合理的是
选项 | 实验目的 | 实验方案 |
A | 除去粗盐中的泥沙 | 将粗盐溶解、蒸发 |
B | 区分羊毛和腈纶 | 取样,点燃,闻气味 |
C | 除去CaO中的CaCO3 | 加入适量的稀盐酸 |
D | 探究Hg和Ag的金属活动性 | 分别伸入稀硫酸,观察现象 |
A. A B. B C. C D. D
【题目】如图所示为实验室中常见的气体制备、净化、收集和性质实验的部分仪器。试根据题目要求,回答下列问题(所选仪器装置,填写序号字母):
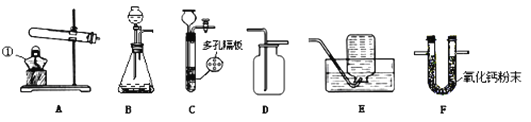
(Ⅰ)写出仪器①的名称:①_____________ 。
(Ⅱ)若用双氧水与二氧化锰为原料制取并收集一瓶干燥的氧气。则应选的气体发生装置为___,反应的化学方程式为______________;应选的气体干燥装置为________。
(Ⅲ)科技小组的同学对实验室制取CO2的实验条件展开了探究,探究实验如下表:
实验编号 | 反应物 | 反应现象 | |
① | 取mg块状大理石 | 足量的溶质质量分数为5%的盐酸 | 产生气泡较慢 |
② | 取mg大理石粉末 | 足量的溶质质量分数为5%的盐酸 | 产生气泡快 |
③ | 取mg块状大理石 | 足量的溶质质量分数为10%的盐酸 | 产生气泡较快 |
④ | 取mg大理石粉末 | 足量的溶质质量分数为10%的盐酸 | 产生气泡很快 |
实验结论:影响大理石和盐酸反应快慢的因素有______ 、________。

