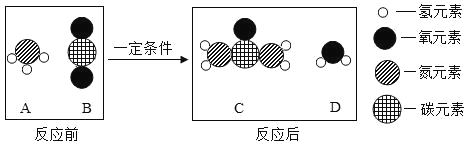
题目内容
【题目】如图是某学校化学课外学习小组设计的探究工业炼铁原理及产物验证的实验。实验 中所用氧化铁的质量为1Og,硬质玻璃管的质量为50g。

(1)B装置中反应的化学方程式是______________________;E装置中反应的化学方程式是____________________,该反应是___________(选填“吸”或“放”)热反应.
(2)从实验安全的角度考虑D瓶中应盛放的试剂是______________。
(3)F装置的作用是_____________、_________________。
(4)为探究E装置中黑色粉末的成分是什么,同学们将反应后的黑色固体研细后,用磁铁吸引,发现黑色粉末全部能被吸引。当装置冷却后称得E装置中玻璃管和固体的总质量为59g.则剩余黑色固体中铁元素质量为______。根据上述实验数据处理得出产物中黑色因体的成分是_______________。
【答案】 ![]()
![]() 吸 浓硫酸 检验二氧化碳 处理尾气 7g FeO
吸 浓硫酸 检验二氧化碳 处理尾气 7g FeO
【解析】A装置内碳和二氧化碳在高温下反应生成一氧化碳,但是A二氧化碳一般会有剩余,所以从A中出来气体有一氧化碳和二氧化碳的混合物,B中的氢氧化钠和二氧化碳反应生成碳酸钠和水;C中石灰水不变浑浊,说明二氧化碳已经被吸收干净。E装置中一氧化碳和氧化铁反应生成铁的二氧化碳,反应的化学方程式是Fe2O3+3CO高温2Fe+3CO2。反应需要一直高温加热,说明反应吸热;(2)从实验安全的角度考虑D瓶中应盛放的试剂是浓硫酸,干燥气体,防止E中反应进行时会有水冷凝,使试管炸裂。(3)F装置的作用是检验二氧化碳 ,澄清石灰水变浑浊证明E中有二氧化碳生成。同时还可将尾气中的一氧化碳点燃,防止污染空气。10g氧化铁中铁元素的质量是:10g×![]() ×100%=7g,氧元素的质量为10g-7g=3g;由质量守恒定律可知,化学反应中元素的种类、质量不变,所以反应后的固体中铁元素的质量仍是7g,反应中减少的质量是以气体的形式逸出的氧元素的质量,所以反应后固体中氧元素的质量为2g,铁和氧元素的质量为:7:2,设铁的氧化物为FexOy,56x:16y=7:2,x:y=1:1,所以黑色固体是氧化亚铁。
×100%=7g,氧元素的质量为10g-7g=3g;由质量守恒定律可知,化学反应中元素的种类、质量不变,所以反应后的固体中铁元素的质量仍是7g,反应中减少的质量是以气体的形式逸出的氧元素的质量,所以反应后固体中氧元素的质量为2g,铁和氧元素的质量为:7:2,设铁的氧化物为FexOy,56x:16y=7:2,x:y=1:1,所以黑色固体是氧化亚铁。

 阅读快车系列答案
阅读快车系列答案【题目】镍粉常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。
I、【镍粉制备】:
工业用电解镍新液(主要含NiSO4、NiCl2)制备碱式碳酸镍晶体xNiCO3·yNi(OH)2·zH2O,并利用其制备镍粉的流程如下:
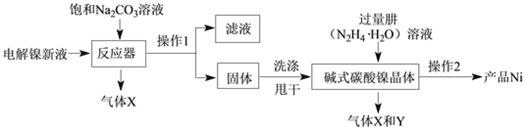
(1)反应器中的一个重要反应为3NiSO4 + 3Na2CO3 + 2H2O = NiCO3·2Ni(OH)2 +3Na2SO4 + 2X,X的化学式为______。
(2)物料在反应器中反应时需要控制反应条件。
分析下图,反应器中最适合的温度及pH分别为______℃、______。
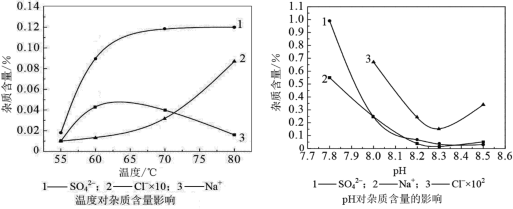
(3)生产中,pH逐渐增加,生成Ni(OH)2含量也相对增加,则生成的碱式碳酸镍晶体中,镍的含量将______(填“升高”、“降低”或“不变”)。
(4)操作1的名称是_______________,实验室完成此操作,需要的玻璃仪器是烧杯、玻璃棒及_________,其中玻璃棒的作用是_____。
(5)固体洗涤时,需用纯水洗涤,检验其洗涤干净的试剂是______。
(6)气体Y是空气中含量最多的气体,其是______(填名称)。
(7)操作2含过滤、水洗、95%酒精浸泡、晾干等操作,其中用95%酒精浸泡的目的是______。
II、【测定碱式碳酸镍晶体的组成】:为测定碱式碳酸镍晶体(xNiCO3·yNi(OH)2·zH2O)组成,某小组设计了如下实验方案及装置:
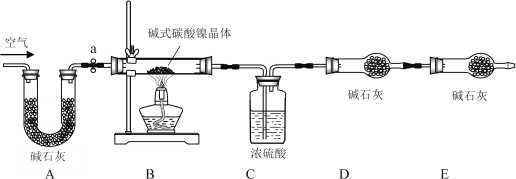
【资料卡片】:
①碱式碳酸镍晶体受热会完全分解生成NiO、CO2及H2O。
②400℃左右,NiO会氧化生成Ni2O3。
③碱石灰是NaOH及CaO的混合物,可以吸收CO2和H2O。
【实验步骤】:
①______;②准确称取3.77g xNiCO3·yNi(OH)2·zH2O放在B装置中,连接仪器;③打开弹簧夹a,鼓入一段时间空气,称量装置C、D的质量;④关闭弹簧夹a,加热装置B至装置C中导管末端无气泡冒出;⑤打开弹簧夹a,______;⑥准确称量装置C、D的质量;⑦根据数据进行计算(相关数据如表)。
装置C / g | 装置D / g | 装置E / g | |
加热前 | 200.00 | 180.00 | 180.00 |
加热后 | 201.08 | 180.44 | 180.00 |
【实验分析及数据处理】:
(8)完善实验步骤中的填空:①______;⑤______。
(9)计算xNiCO3·yNi(OH)2·zH2O中x:y:z的值______。
(10)左侧通空气的目的是______、______。
【实验反思】:
(11)实验结束后,称得装置B中残留固体质量为2.33g。请通过计算确定残留固体的组成及各成分的质量(写出计算过程,精确到小数点后两位)_____。