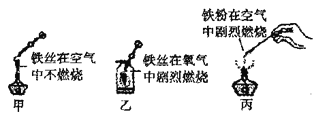
题目内容
【题目】在某工业食盐中除含有不溶性杂质外,还含有少量硫酸钠,欲通过下列流程除去其中的杂质,得到纯净的氯化钠晶体。试根据提问填空:
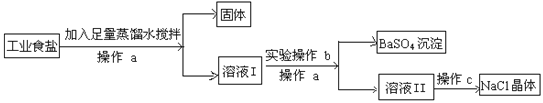
(1)操作a 的名称是 。
(2)操作c 的名称是 。
(3)若要将硫酸钠除尽且不带入新的杂质,则操作b的具体操作过程是:向溶液I中 ,直至 为止。
(4)请写出操作b发生反应的化学方程式 。
【答案】(1)过滤 (2)蒸发(或蒸发结晶) (3)逐滴滴加氯化钡溶液(或加入适量氯化钡溶液) 不再产生沉淀 (4)Na2SO4+BaCl2=2NaCl+BaSO4↓
【解析】
分析:(1)根据操作a前后物质的不同,可发现该操作把溶液中不溶性固体分离出来,从而判断该操作;
(2)获得晶体有降温结晶和蒸发结晶两种途径,由于氯化钠的溶解度受温度影响不大,因此可判断获得氯化钠晶体的方法应为蒸发结晶;
(3)为除去硫酸钠得到纯净的氯化钠,应加入氯化钡溶液除去硫酸钠,为确定加入的氯化钡恰好完全反应,可采取逐滴滴加并至沉淀不再产生为止;
(4)硫酸钠与氯化钡发生复分解反应,通过交换成分生成硫酸钡沉淀和氯化钠,据此写出该反应的化学方程式.
解答:解:(1)操作a可把不溶于水的固体杂质从溶液中分离而除去,该操作应为过滤;
(2)由于氯化钠的溶解度受温度影响不大,因此获得氯化钠晶体时应采取蒸发结晶的方法;
(3)利用硫酸钠能与氯化钡反应而得到氯化钠,为将硫酸钠除尽且不带入新的杂质,则应逐滴滴加氯化钡溶液至不再产生沉淀,则可达到除尽硫酸钠时又不引入新的杂质;
(4)根据复分解反应交换成分的特点,硫酸钠与氯化钡反应生成硫酸钡沉淀和氯化钠,反应的化学方程式为Na2SO4+BaCl2=2NaCl+BaSO4↓.
故答案为:
(1)过滤;
(2)蒸发(或蒸发结晶);
(3)逐滴滴加氯化钡溶液(或加入适量氯化钡溶液),不再产生沉淀;
(4)Na2SO4+BaCl2=2NaCl+BaSO4↓

【题目】小华想测定Cu—Zn合金中铜的质量分数,实验室只提供了一瓶稀盐酸和相关的仪器。为了测定该合金的组成,小华称取10克该合金粉末,在粉末中连续三次加入稀盐酸反应。每加一次盐酸,小华记录所得气体的质量,实验数据如下:
第一次 | 第二次 | 第三次 | |
连续加入盐酸的体积(ml) | 10 | 10 | 10 |
生成氢气的质量(g) | 0.08 | 0.08 | 0.04 |
(1)从上表数据分析,小华用10克合金粉末总共收集到___________克氢气。
(2)求出该合金中铜的质量分数为_________。(提示:Cu不与稀盐酸反应,锌与稀盐酸反应的化学方程式为Zn+2HCl=ZnCl2+H2↑)