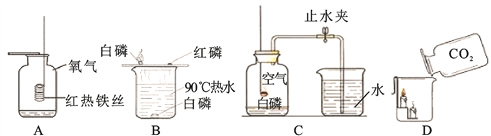
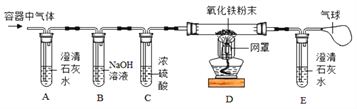
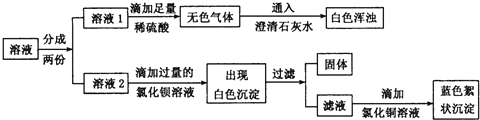
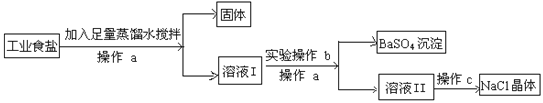
题目内容
【题目】下图是某硫酸试剂瓶标签上的部分文字说明。
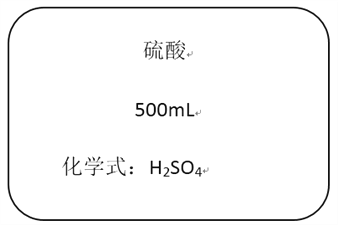
(1)取10mL该硫酸可配制成9.8%的硫酸____________________g。
(2)取适量该硫酸与锌反应可生成S02气体:Zn+2H2SO4 (浓)=ZnSO4+SO2↑+2H2O。反应一段时间后,还可能生成另一种气体,请解释其原因。_______________
【答案】 184 随着硫酸的消耗和水的生成,硫酸变稀,锌与稀硫酸反应能生成氢气
【解析】(1)依据稀释前后溶质的质量不变,可设配置溶液的质量是x,10ml×1.84g/ml×98%=x×9.8%,则:x=184g;
(2)由浓硫酸与锌反应的方程式Zn+2H2SO4 (浓)=ZnSO4+SO2↑+2H2O可以看出随着硫酸的消耗和水的生成,硫酸变稀,这时就会发生锌与稀硫酸反应能生成氢气。

练习册系列答案
相关题目
【题目】某化学兴趣小组为了测定镁铜合金中镁的质量分数,取了该合金样品2.0g并将30稀硫酸分6次加入样品中。充分反应后过滤,称重,得到相关数据如下:
稀硫酸的用量 | 剩余固体质量 | 稀硫酸的用量 | 剩余固体质量 |
第一次 5 g | m | 第四次 5 g | 0.8 g |
第二次 5 g | 1.4g | 第五次 5 g | 0.6g |
第三次 5 g | 1.1g | 第六次 5 g | 0.6g |
(1) 表格中m的数值为________。
(2) 样品中镁的质量分数为________。
(3) 求所用硫酸溶液中溶质质量分数为_____________。