题目内容
【题目】利用对照实验进一步认识氧气和二氧化碳。
Ⅰ.性质
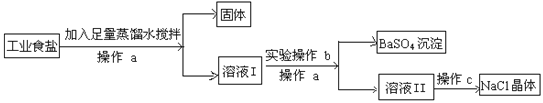
(1)图为铁在不同情况下与氧气反应的实验。
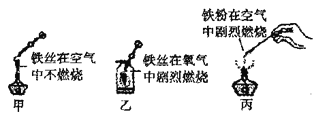
①比较实验甲与乙,产生不同现象的原因是__________________。
②从燃烧条件分析。实验乙在铁丝上绑一根火柴的作用是_______________
③实验丙的产物与乙相同,写出反应的化学方程式________________。
④上述实验中,能说明“反应物与氧气接触的面积不同,现象不同”的是_______(填标号)。
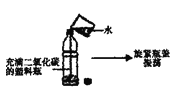
(2)如图为二氧化碳的性质实验。观察到的现象是_________。为了证明二氧化碳与水反应,可将烧杯中的水换成______________(填物质名称)。
Ⅱ.制取
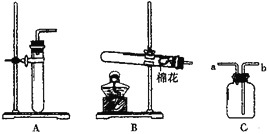
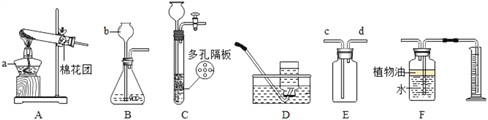
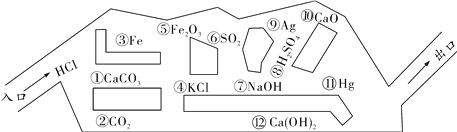
(3)实验室制取二氧化碳的药品为__________(填名称);选择的气体发生装置为________(填标号)。用装置C收集二氧化碳时,应将燃着木条放在_______(填“a”或“b”)端管口进行验满。
(4)实验室用装置B制备氧气,反应的化学方程式为______________。若用充满水的c装置收集氧气,氧气须从____________(填“a”或“b”)端管口通入。
【答案】 氧气的浓度不同 引燃使铁丝的温度达到着火点 3Fe+2O2![]() Fe3O4 甲丙(或甲乙) 瓶子变瘪 紫色石蕊溶液 大理石(或石灰石)与稀盐酸 A a 【答题空10】2KMnO4
Fe3O4 甲丙(或甲乙) 瓶子变瘪 紫色石蕊溶液 大理石(或石灰石)与稀盐酸 A a 【答题空10】2KMnO4![]() K2MnO4+MnO2+O2↑ a
K2MnO4+MnO2+O2↑ a
【解析】本题考查了(1)铁在氧气中燃烧的实验,根据燃烧条件进行分析;(2)二氧化碳的性质;(3)装置的选择,选择发生装置时,要考虑反应物的状态、反应条件等因素,选择收集装置时,要考虑气体的水溶性、密度、能否和空气中的物质发生化学反应等因素。
①铁在空气中不能燃烧,在氧气中能燃烧,产生不同现象的原因是氧气的浓度不同;
②在螺旋状铁丝的末端系一根火柴的作用是引燃使铁丝的温度达到着火点;
③铁在氧气中燃烧生成四氧化三铁,反应的化学方程式是3Fe+2O2![]() Fe3O4;
Fe3O4;
④铁丝与铁粉不同之处是与氧气的接触面积,能说明“反应物与氧气接触的面积不同,现象不同”的是甲丙(或甲乙);
(2)二氧化碳与水反应生成碳酸,碳酸呈酸性。如图的实验可观察到的现象是瓶子变瘪;为了证明二氧化碳与水反应,可将烧杯中的水换成紫色石蕊溶液;
(3)实验室制取二氧化碳的药品为大理石(或石灰石)与稀盐酸;大理石(或石灰石)与稀盐酸的反应是固体和液体混合,不需要加热,属于固—液常温型,选择的气体发生装置为A。二氧化碳的密度比空气大,用装置C收集二氧化碳时应从b端管口通入,所以应将燃着木条放在a端管口进行验满;
(4)装置B加热制氧气,管口有一团棉花,实验室用装置B制备氧气,用高锰酸钾加热生成锰酸钾和二氧化锰和氧气,反应的化学方程式为2KMnO4 ![]() K2MnO4+MnO2+O2↑ 。氧气的密度比水小,若用充满水的c装置收集氧气,氧气须从a端管口通入。
K2MnO4+MnO2+O2↑ 。氧气的密度比水小,若用充满水的c装置收集氧气,氧气须从a端管口通入。

 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】溶液在生产、生活中起着十分重要的作用。
(1)可作为溶质的是_______。
A.只有固体 B. 只有液体
C.只有气体 D. 气体、液体、固体都可以
(2)物质加入足量水中,能形成无色透明溶液的是_______。
A.汽油 B. 面粉 C. 纯碱 D. 硫酸铜
(3)物质加入水中形成溶液过程中,温度会升高的是_______。
A.烧碱 B. 氯化钠 D. 氧化钙 D. 碳酸钙
(4)下表是NaCl和KNO3在不同温度时的溶解度,回答问题。
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度g/100g水 | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 | |
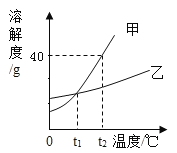
①两种物质中,溶解度受温度影响变化较大的是__________。
②NaCl和KNO3溶解度相等的温度范围是__________。
③KNO3晶体中含有少量NaCl,提纯KNO3晶体的方法是__________。
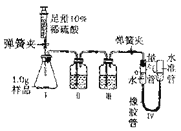
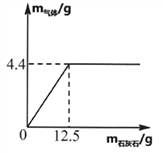
④60℃时,按图示操作:
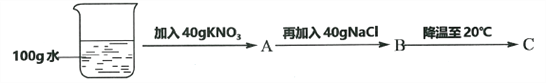
A中溶液是__________(填“饱和”或“不饱和”)溶液,C中溶液的总质量是__________g。
⑤50℃时,将两种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到50℃,剩余溶液的质量:NaCl溶液__________(填“大于”“等于”或“小于”)KNO3溶液。
【题目】某化学兴趣小组在探究稀盐酸的化学性质时,做了如图一所示的三个实验。
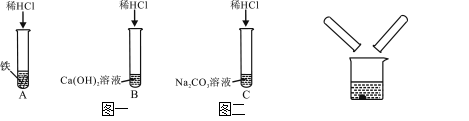
(1)A试管中的反应现象是 。
(2)C试管中反应的化学方程式是 。
(3)实验结束后,小组同学将B、C两支试管中的废液同时倒入一个洁净的烧杯中(如图二所示),观察到先有气泡产生,后有白色沉淀生成。同学们将烧杯内的物质进行过滤,对所得滤液的溶质成分进行探究。
【提出猜想】
甲同学猜想:有NaCl
乙同学猜想:有NaCl、CaCl2
丙同学猜想:有NaCl、CaCl2、 HCl
你的猜想:有 。
【交流讨论】
你认为 同学的猜想一定不正确,理由是 。
【设计实验】请设计实验证明你的猜想正确。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,向其中滴加 。 | _________________。 | 我的猜想成立 |
【反思与总结】判断反应后溶液中溶质的成分,除要考虑生成物外,还需考虑 。