题目内容
【题目】化学与人类密切相关,我们身边到处都是化学物质。
(1)饮用硬度过大的水不利于人体健康,生活中常用___________来鉴别硬水软水。
(2)生活中,通常选择铜丝作为导线,是利用其____________性。
(3)实验室比较锌和银的金属活动性强弱,用化学方程式表示:_____________________________。
(4)化学为人类发展作出了巨大贡献,但也带来了污染,请你写出一种生活中防止污染的做法:_____。
【答案】肥皂水 导电 ![]() (合理即可) 垃圾分类处理(合理即可)
(合理即可) 垃圾分类处理(合理即可)
【解析】
(1)饮用硬度过大的水不利于人体健康,生活中常用肥皂水来鉴别硬水软水,产生泡沫多的为软水。
(2)生活中,通常选择铜丝作为导线,是利用其导电性。
(3)实验室比较锌和银的金属活动性强弱,可将锌片放入硝酸银溶液中,如有不溶于酸的银白色固体生成,可说明锌的金属活动性比银强,用化学方程式表示: ![]() )。
)。
(4)化学为人类发展作出了巨大贡献,但也带来了污染,生活中防止污染的做法有: 垃圾分类处理、禁止燃放鞭炮、禁止焚烧稻杆等。

 课时训练江苏人民出版社系列答案
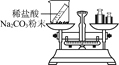
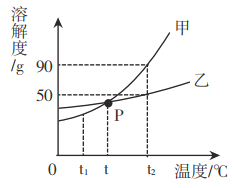
课时训练江苏人民出版社系列答案【题目】以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
【提出问题】 化学反应前后各物质的质量总和是否相等?
【查阅资料】 氢氧化钠溶液可以吸收二氧化碳气体
【猜想与假设】 猜想1:不相等;猜想2:相等。
【实验探究】 甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲组 | 乙组 | |
实验方案(反应后略) |
|
|
实验现象 | 有气泡产生,天平指针向右偏转 | _________,天平指针没有偏转 |
结论 | 猜想1正确,反应的化学方程 式:_______________. | 猜想2正确 |
【反思评价】 究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体溢出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在_______________中进行。
【优化装置】 同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是(填序号)___,从另外两种装置中任选一种指出其不足:________。
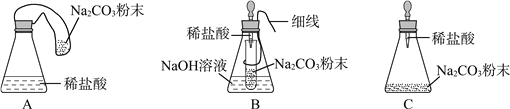
【得出结论】 同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确。进一步
分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论:_________________________的各物质的质量总和等于反应后生成的各物质的质量总和。
【解释应用】
解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由_________种元素组成。
【题目】下列实验的操作、现象、结论均正确的是![]()
实验操作 | 现象 | 结论 | |
A | 向收集满CO2的软塑料瓶中加入约三分之一体积的NaCl溶液,旋紧瓶盖,振荡 | 塑料瓶变瘪 | CO2能与NaCl反应 |
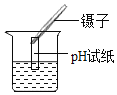
B | 用玻璃棒取少量待测液滴在湿润的pH试纸上,与标准比色卡对照并读出待测液的pH | pH试纸显示pH=1对应的红色 | 待测液显酸性 |
C | 将白磷浸没在热水中,再向热水中的白磷通氧气 | 通氧气前白磷不燃烧,通氧气后白磷燃烧 | 氧气是燃烧需要的条件之一 |
D | 点燃从导管放出的某气体,在火焰上方罩一个冷而干燥的烧杯。 | 烧杯内壁有无色液滴产生 | 该气体一定是CH4 |
A.AB.BC.CD.D