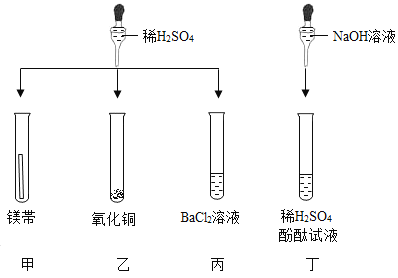
题目内容
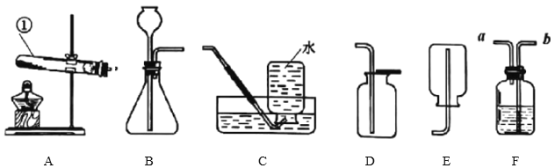
【题目】下列实验的操作、现象、结论均正确的是![]()
实验操作 | 现象 | 结论 | |
A | 向收集满CO2的软塑料瓶中加入约三分之一体积的NaCl溶液,旋紧瓶盖,振荡 | 塑料瓶变瘪 | CO2能与NaCl反应 |
B | 用玻璃棒取少量待测液滴在湿润的pH试纸上,与标准比色卡对照并读出待测液的pH | pH试纸显示pH=1对应的红色 | 待测液显酸性 |
C | 将白磷浸没在热水中,再向热水中的白磷通氧气 | 通氧气前白磷不燃烧,通氧气后白磷燃烧 | 氧气是燃烧需要的条件之一 |
D | 点燃从导管放出的某气体,在火焰上方罩一个冷而干燥的烧杯。 | 烧杯内壁有无色液滴产生 | 该气体一定是CH4 |
A.AB.BC.CD.D
【答案】C
【解析】
A、二氧化碳能溶于水、能与水反应生成碳酸,向收集满CO2的软塑料瓶中加入约体积的NaCl溶液,旋紧瓶盖,振荡,塑料瓶变瘪,不能证明CO2能与NaCl反应,也可能是二氧化碳溶于水、与水反应造成的,故选项实验结论错误。
B、应用玻璃棒蘸取少量待测液滴在pH试纸上,不能滴在湿润的pH试纸上,故选项操作结论错误。
C、将白磷浸没在热水中,再向热水中的白磷通氧气,通氧气前白磷不燃烧,通氧气后白磷燃烧,说明氧气是燃烧需要的条件之一,故选项实验结论正确。
D、点燃从导管放出的某气体,在火焰上方罩一个冷而干燥的烧杯,烧杯内壁有无色液滴产生,说明生成了水,该气体不一定是CH4,也可能是氢气等,故选项实验结论错误。
故选:C。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】化学小组同学在课外读物中看到:“加热时,过氧化钠(Na2O2)能与木炭发生化学反应”。他们决定探究Na2O2与木炭反应的产物。
(猜想与假设)木炭与Na2O2反应可能生成4种物质:CO、CO2、Na2O和Na2CO3。
(查阅资料)
① 碱性的碳酸钠溶液与中性的CaCl2溶液能发生复分解反应。
② 氧化钠(Na2O)是白色固体,与H2O反应生成NaOH。
③ 氯化钯(PdCl2)溶液能检验CO的存在,向溶液中通入CO,产生黑色沉淀。
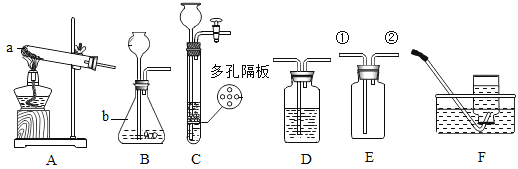
(进行实验)同学们在老师的指导下设计了如下图所示装置(部分夹持仪器已略去)。
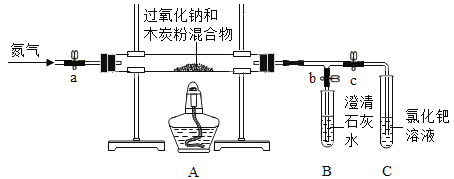
序号 | 实验操作 | 主要实验现象 | 实验结论 |
① | 检查装置气密性。向玻璃管中加入过氧化钠和过量木炭粉的混合物。打开弹簧夹a、b,关闭c,从装置左端通一段时间N2。 | A中无明显变化,B中有大量气泡冒出。 | 气密性良好。 |
② | 关闭a,点燃酒精灯。 | 试管中发生剧烈反应,产生火花,________________。 | 产物中没有CO2。 |
③ | 打开c,关闭b。 | C中PdCl2溶液没有明显变化。 | ___________________。 |
④ | 打开a,继续通N2,停止加热,待冷却后停止通N2。取出少量反应后固体于试管中,加入足量稀盐酸,迅速用带导管的橡胶塞塞紧试管口,导管另一端通入石灰水中。 | _____________________。 | 产物中有Na2CO3。 |
(解释与结论)
(1)检验第4种物质存在的实验方案:取出少量反应后固体于试管中,_______________,则第4种物质存在。
(2)Na2O2与木炭反应的化学方程式为_________________________________。
(反思与评价)实验操作④中若不通入N2,可能造成的结果是________________________。