题目内容
【题目】如图是a、b、c三种物质的溶解度曲线,根据图象及相关知识判断,下列说法中正确的是( )
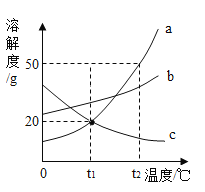
A. 在t2℃时,a物质的饱和溶液的溶质质量分数等于c物质溶液的溶质质量分数
B. a、b两种物质的饱和溶液,从t1℃升高到t2℃时,所得物质溶液溶质的质量分数a>b
C. t1℃时,100g a、c两物质的溶液中,含a、c的质量相等
D. t2℃时,等质量a、b、c三种物质的饱和溶液,温度降低到0℃时,所得溶液中溶剂质量最多的是c
【答案】D
【解析】
根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
A、在t2℃时,a物质的溶解度大于c物质的溶解度,所以a物质的饱和溶液的溶质质量分数大于c物质溶液的溶质质量分数,故A不正确;
B、a、b两种物质的饱和溶液,从t1℃升高到t2℃时,溶解度不变,溶质不变,溶剂不变,所以所得物质溶液溶质的质量分数a<b,故B不正确;
C、t1℃时,100g a、c两物质的溶液中,溶液状态不能确定,所以含a、c的质量不能确定,故C不正确;
D、t2℃时,a物质的溶解度最大,c物质的溶解度最小,所以等质量a、b、c三种物质的饱和溶液中,c溶液中的溶剂质量最大,所以温度降低到0℃时,溶剂质量不变,还是t2℃时的溶剂质量,所得溶液中溶剂质量最多的是c,故D正确。故选D。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
(演示实验)将一定量的稀H2SO4加入到盛有NaOH溶液的烧杯中.
(学生板演)该反应的化学方程式_____.
Ⅰ.定性探究
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
(猜想)针对疑问大家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.你认为不合理的猜想是哪一种并说出理由_____.
(继续实验)(1)丙组同学取烧杯中的少量溶液于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有_____.
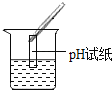
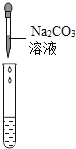
(2)为了验证其余猜想,各组同学取烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,分别进行如表三组探究实验.
实验方案 | ①测溶液pH | ②滴加Na2CO3溶液 | ③滴加BaCl2溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,与标准比色卡比照,得pH<7 | _____ | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(得出结论)通过探究,全班同学一致确定猜想二是正确的.
(评价反思)老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定.同时也指出上述三个实验探究中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中明显的一处错误是_____;
(2)实验方案探究中也有一个是不合理的,这个方案是_____(选填①、②、③),不合理的原因是_____.
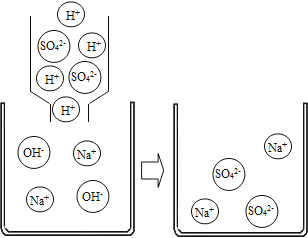
(剖析本质)实验后,老师又带领大家从微观的角度来理解此反应的实质,请你和同学们一起在如图反应后的方框中补画未画全的微粒____.
II.定量探究
取上述(演示实验)反应后烧杯中的溶液100g,设计如图实验:

试计算上述(演示实验)反应后溶液中Na2SO4的质量分数是___________?(列出计算过程)