��Ŀ����
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣��밴Ҫ��ش�
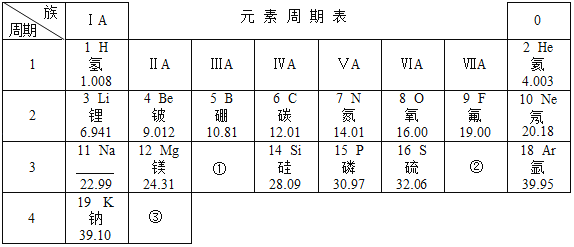
(1)��Ԫ�ص����ԭ������Ϊ___��
(2)ijԪ�ص�ԭ�ӽṹʾ��ͼ��ͼ�����ڱ��е�λ����___(�������������������)���ڻ�ѧ��Ӧ��һ����___(�����õ�������ʧȥ��)���ӣ�������___(���������������ǽ�����)Ԫ�ء�
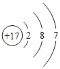
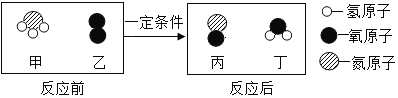
(3)ԭ�����Ϊ8��11��Ԫ�����Ʒֱ�Ϊ__��___��������ɻ�����Ļ�ѧʽ___��
(4)��������ѧ���������˹��ϳ��˵�118��Ԫ�أ����Ԫ�صĺ˵����Ϊ___��
(5)���У���ͬ��Ԫ����ʵ�������___(����ĸ)��
A ��������ͬ B ���ԭ��������ͬ C ��������ͬ
(6)���У���ԭ�Ӻ��ڵ���������___��
���𰸡�30.97 �� �õ� �ǽ��� ��Ԫ�� ��Ԫ�� Na2O 118 A 20
��������
(1)��Ԫ�ص����ԭ������Ϊ30.97�����30.97
(2)ijԪ�ص�ԭ�ӽṹʾ��ͼΪ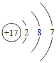 ����Ԫ������Ԫ�أ����ڱ��е�λ���Ǣڣ�������������7���ڻ�ѧ��Ӧ��һ���õ����ӣ������ڷǽ���Ԫ�ء�����ڣ��õ����ǽ���
����Ԫ������Ԫ�أ����ڱ��е�λ���Ǣڣ�������������7���ڻ�ѧ��Ӧ��һ���õ����ӣ������ڷǽ���Ԫ�ء�����ڣ��õ����ǽ���
(3)ԭ�����Ϊ8��11��Ԫ�����Ʒֱ�Ϊ��Ԫ�ء���Ԫ�أ�������ɻ������������ƣ�����������Ԫ�ػ��ϼ���+1����Ԫ�ػ��ϼ��ǩ�2�����ݻ�������Ԫ�ػ��ϼ۴�����Ϊ���֪�������ƵĻ�ѧʽ��Na2O�������Ԫ�أ���Ԫ�أ�Na2O
(4)��������ѧ���������˹��ϳ��˵�118��Ԫ�أ����Ԫ�صĺ˵����Ϊ118�����118
(5)���У���ͬ��Ԫ����ʵ���������������ͬ�����A
(6)���У���ԭ�Ӻ��ڵ��������ǣ�39��19��20�����20

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ij��ѧС�����������ʵ��̽����
��������⣩��Һ�и��ֽⷴӦ��ʵ����ʲô��
���������ϣ�
�ٵ絼�ʴ��������ڲ�����Һ�ĵ�����ǿ�����ܷ�Ӧ����Ũ�ȴ�С��
����ͬ�¶���ͬ����Һ�絼��Խ������Ũ��Խ��
��ʵ��һ���ⶨ������Һ�ĵ絼��
�����£��ֱ�ȡ20mL����Һ�����ձ��У�����絼�ʴ�������ͼ1������������±������ձ��е����ʾ����ڿ����б��ã�
���� | ������ˮ | ��ϡ���� | ������������Һ | �����ᱵ����Һ |
�絼��/����S/cm�� | 3 | 5923 | 6316 | 3 |
��1��������ʢ٢������ʢڢ۵ĵ絼�����ݲ�����ԭ����_________��
��ʵ������ⶨ����������ϡ���ᷴӦ�����еĵ絼��
�����£��������ձ��е�����������Һ����10mL����һ�ձ��У������еμ�2-3����ɫ��̪��Һ������絼�ʴ�������Ȼ��μ�ϡ���ᣬ�����Һ�ĵ絼�ʱ仯��ͼ2�м�������ʾ��
��2��д���������������ᷴӦ�Ļ�ѧ����ʽ��___________��
��3��M��ʱ�絼�ʼ���Ϊ���ԭ����__________.
��4��ͨ���Լ����ߵķ���������˵���������_______������ĸ��ţ���
A M��ǰ�����»��Ĺ����У�H+��OH-��ϳ�H2O��Ba2+��SO42-��ϳ�BaSO4
B M�����Һ�絼��������������BaSO4��һ�������Ba2+��SO42-
��ʵ�������ⶨ���������������Ʒ�Ӧ�����еĵ絼��
�����£���ʵ�����ϡ�����Ϊ��������Һ���ظ�����ʵ�飬�����Һ�ĵ絼�ʱ仯��ͼ2����������ʾ��
��5��д��������������������Ӧ�Ļ�ѧ����ʽ____________��
��6���Ա������ߵ���͵㣬N���M�����Ըߵ�ԭ����_____��P��ʱ��Һ�д������е�������_____�������ӷ��ţ���
�����ۣ�
��7��ͨ���ȽϷ����������ѧ֪ʶ��֪����Һ�и��ֽⷴӦ��ʵ���Dz��뷴Ӧ�����ӽ�������˳����������ˮ��������Ũ��_______������������������С������
����չ�뷴˼��
��8����һ�������ͳ���ʯ��ˮ�г���ͨ������Ķ�����̼���壬��Һ�ȱ���Ǻ��������ʧ���Ʋ�˹��̵���Һ��Ca2+��Ũ�ȱ仯�����____________��
��9��ʵ����иտ�ʼʱ������������Һ�ĵ絼��С��ʵ��һ�в�õ�6316��S/cm��ԭ�������________��
��10������ʵ��һ�����ʢ���۷�Ӧ���ⶨ�絼����ʱ��ı仯��������Ʋ���Һ�ı仯���߿�����_____________����������������������