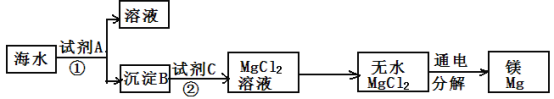题目内容
【题目】(10分)某校初三化学学习小组的同学前往某地的石灰石矿区进行调查,他们取回矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:
甲组同学:
测定某石灰石样品中碳酸钙的质量分数,其方法是:将样品与稀盐酸反应,测定反应后生成CO2的体积,再根据体积换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量。右图为大理石与稀盐酸反应的反应装置,并测量CO2的体积。(其他仪器省略)
(1)下图中左侧的橡皮管的作用是 。下图中装置中油层的作用是 。
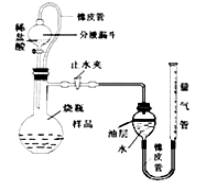
(填操作方法)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积。
乙组同学:
【查阅资料】1.氢氧化钠溶液可以吸收二氧化碳气体
2.碱石灰可以吸收二氧化碳气体和水分
取样品,研成粉状后,按下图进行实验。
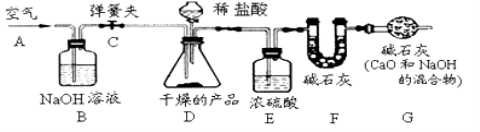
(1)实验步骤:
①连接好装置,检查气密性;
②打开弹簧夹C,在A处缓缓通入一段时间空气;
③称量F的质量;
④关闭弹簧夹C,慢慢滴加稀盐酸至过量,直至D中无气泡冒出;
⑤打开弹簧夹C,再次快速通一段时间空气;
⑥称量F的质量,计算前后两次质量差。最后根据CO2的质量求出样品中碳酸钙的质量
(2)问题探究:
①产品研成粉状的目的 ;
②B装置的作用是 ;
G装置的作用是 。
③若没有E装置,则测定的CaCO3的质量分数会 (填“偏大 偏小 不变”)。
④在步骤②打开弹簧夹C,在A处缓缓通入一段时间空气的目的是 。
总结反思:
(1)甲组同学们认为即使排除实验仪器和操作的影响,测定的结果仍不一定准确,甲组中,可能造成实验结果与真实值相比偏小的原因是 。
(2)在乙组实验步骤中,可能造成实验结果与真实值相比偏大的原因是 。
【答案】甲组同学(1)使分液漏斗和烧瓶内的气压始终保持平衡 ( 2) 防止CO2溶于水。
(3)反应结束冷却,关闭止水夹,调节量气管高度,使反应前后两边液面相平。
乙组同学(2)①增大与盐酸的接触面积加快反应速率,使反应进行的更充分
②吸收除去空气中的二氧化碳,以免对实验干扰 ;
防止空气中二氧化碳和水份进入F中以免对实验干扰 ③偏大
④排除装置内空气中二氧化碳气体,以免对实验干扰
总结反思:(1)二氧化碳溶于水中 (答案合理均给分)
(2)步骤⑤中快速通空气使空气中二氧化碳没有吸收完全(或氢氧化钠溶液不足量,答案合理均给分)
【解析】
试题分析:甲组同学:
大理石与稀盐酸反应会生成二氧化碳气体,导致压强变大,故橡皮管的作用是使分液漏斗和烧瓶内的气压始终保持平衡;
测量生成的二氧化碳气体的体积,就要用排水法,即通过用量筒测量用二氧化碳气体排出的水的体积,从而测得二氧化碳的体积,但二氧化碳能溶于水,且与水反应,所以要在水的上方放一层植物油,以防止二氧化碳与水接触;
反应结束冷却,关闭止水夹,调节量气管高度,使反应前后两边液面相平,可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积;
乙组同学:
(2)接触面积越大,反应越剧烈,故产品研成粉状的目的是增大与盐酸的接触面积加快反应速率,使反应进行的更充分;由于空气中含有二氧化碳,故B装置的作用是除去空气中的二氧化碳,以免对实验干扰;由于空气中含有的二氧化碳和水蒸汽会对实验造成干扰,故G装置的作用是防止空气中二氧化碳和水份进入F中以免对实验干扰;浓硫酸的作用是起干燥作用,若没有该装置则F装置中的碱石灰的质量会变大,即测定的二氧化碳的质量偏大,导致碳酸钙的质量分数偏大;在步骤②打开弹簧夹C,在A处缓缓通入一段时间空气的目的是排除装置内空气中二氧化碳气体,以免对实验干扰;
总结反思:
由于二氧化碳可能会少量溶于水,故实验结果与真实值相比偏小;
乙组实验中若空气中的二氧化碳没有除去,那么会导致实验结果偏大。

【题目】(3分)小苏打(主要成分为NaHCO3)中常含有少量氯化钠。化学兴趣小组的同学为
了测定某品牌小苏打中NaHCO3的质量分数。进行了以下实验:称量样品置于烧杯中,
向其中慢慢滴加稀盐酸,至不再产生气泡为止,测得的有关数据如下表所示。
物 质 | 样 品 | 加入稀盐酸质量 | 反应后烧杯中物质的总质量 |
质量(g) | 18 | 110.8 | 120 |
已知:NaHCO3+HCl== NaCl+H2O+CO2↑
试计算:(计算结果保留一位小数)
(1)样品中NaHCO3的质量分数。
(2)反应后所得NaCl的质量。