题目内容
【题目】海水是一种重要的自然资源。以下是我市对海水资源的部分利用。
(1)从海水中获取淡水。常用的操作方法是 (填一种即可);
(2)从海水中获得氯化钠。将海水进行 可得到粗盐;
(3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。
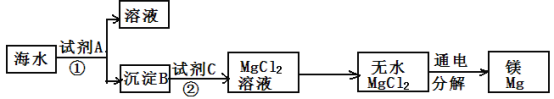
上述过程中,试剂A可由生石灰和水反应得到,此反应为 反应(填“放热”或“吸热”);可通过 (填操作名称)得到沉淀B。
海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:
。
【答案】蒸馏法(其他合理答案均可) 蒸发结晶 放热 过滤 海水中含较多杂质,MgCl2浓度小( 或后者经过富集,MgCl2浓度大
【解析】
试题分析:根据所学物质的性质可知(1)从海水中获取淡水。常用的操作方法是蒸馏法;(2)从海水中获得氯化钠。将海水进行蒸发结晶可得到粗盐;(3)试剂A可由生石灰和水反应得到,此反应为放热反应;可通过过滤得到沉淀B。海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液获得,不同之处为:海水中含较多杂质,MgCl2浓度小( 或后者经过富集,MgCl2浓度大。

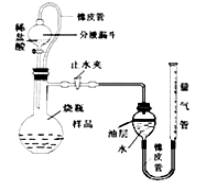
【题目】实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
【提出问题】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3。
则NaOH变质反应的化学方程式为________________________________;
【查阅资料】
碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
【实验探究】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
实验操作 | 实验现象 | 实验结论 |
(1)取少量样品溶于水,加入 ; | 白色沉淀产生 | 该反应的化学方程式为 |
(2)将上述反应后的混合液过滤,取滤液加入 ; | 证明猜想Ⅱ成立。 |