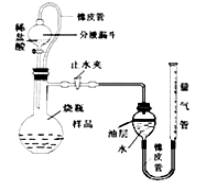
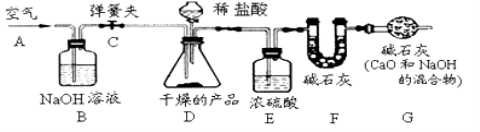
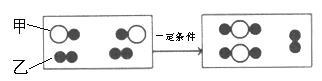
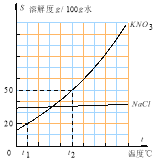
题目内容
【题目】下列实验现象的描述正确的是( )
A.硫在氧气中燃烧产生蓝紫色火焰
B.铁丝在空气中剧烈燃烧,火星四射,生成黑色固体
C.木炭在氧气中剧烈燃烧,发出白光,有二氧化碳气体生成
D.电解水时正极产生的气体比负极产生的气体多
【答案】A
【解析】
试题分析:A、硫在氧气中燃烧,发出明亮的蓝紫色火焰,产生一种具有刺激性气味的气体,故选项说法正确;B、铁丝在空气中只能烧至发红,不会剧烈燃烧,产生火星,故选项说法错误.C.木炭在氧气中剧烈燃烧,发出白光,属于实验现象的描述,但有二氧化碳气体生成是生成物,不是实验现象的叙述;故错误;D选项电解水时正极产生的气体比负极产生的气体少,故是错误的说法,故答案选择A

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目