题目内容
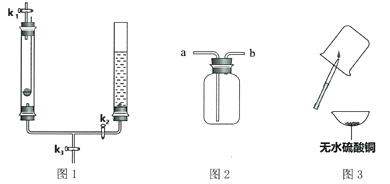
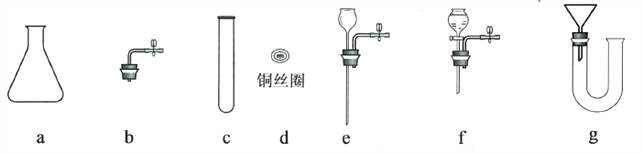
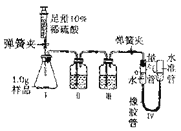
【题目】某过碳酸钠样品中含有少量的碳酸钠等杂质,为测定其纯度,某化学小组同学利用如图装置展开如下探究:
[资料在线]
①过碳酸钠(Na2CO4)和稀硫酸反应的原理为:
2 Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O
②碳酸钠与稀硫酸反应后生成硫酸钠、二氧化碳和水。
③浓硫酸具有强吸水性。氢氧化钠溶液能吸收二氧化碳。
④含钠的化合物可溶于水,样品中其它杂质不溶于水且不参与反应。
⑤该实验条件下,氧气的密度为l.43g/L、二氧化碳的密度l.97g/L。
[实验步骤]
a.连接仪器并检查装置气密性。
b.向装置Ⅰ中的锥形瓶加入1.0g样品,由注射器缓缓注入稀硫酸,待到完全反应后,利用装置Ⅳ测得反应生成的气体体积为82.6 mL;装置I中的溶液经处理,称得硫酸钠固体质量为1.1g。
c.根据测得数据,计算样品中过碳酸钠的质量分数。
[回答问题]
(1)判断样品与稀硫酸完全反应的现象是___________。
写出碳酸钠与稀硫酸反应的化学方程式:___________。
(2)装置Ⅱ和Ⅲ的广口瓶中盛有足量的药品是___________(填标号)。
A.Ⅱ—浓硫酸、Ⅲ—氢氧化钠溶液 B.Ⅱ—氢氧化钠溶液、Ⅲ—浓硫酸
(3)甲同学通过称量装置I中实验前后固体的质量、乙同学通过读取装置IV中气体的体积,分别计算出样品中过碳酸钠质量分数。
①乙同学计算过程中,需要选用___________ (填“氧气”或“二氧化碳”)的密度。
②两位同学的实验结果不同,经分析乙同学实验方案正确。甲同学的实验方案不准确的原因是___________。
【答案】 装置I(或II或III)中不再有气泡产生(或量气管内液面不再下降) Na2CO3+H2SO4==Na2SO4+H2O+CO2↑ B 氧气 甲称得1.1 g Na2SO4的质量由Na2CO4和Na2CO3与稀硫酸共同反应而生成,使得测定结果不准确
【解析】本题在测定过碳酸钠样品的纯度的情境下考查了酸的性质,气体的分离,根据化学方程式的计算以及实验误差的分析。综合性很强,但难度不大,认真阅读,理解题意,利用已有的知识分析解答。
(1) 碳酸钠与稀硫酸反应生成硫酸钠和水和二氧化碳,过碳酸钠(Na2CO4)和稀硫酸反应生成硫酸钠和氧气的二氧化碳和水,都有气体生成,样品与稀硫酸完全反应的现象是装置I(或II或III)中不再有气泡产生(或量气管内液面不再下降);碳酸钠与稀硫酸反应的化学方程式:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑;
(2)装置Ⅱ的作用是吸收二氧化碳和装置Ⅲ的作用是吸收水蒸气,装置Ⅱ和Ⅲ的广口瓶中盛有足量的药品分别是氢氧化钠溶液、浓硫酸,故选B。
(3)甲同学通过称量装置I中实验前后固体的质量、乙同学通过读取装置IV中气体的体积,分别计算出样品中过碳酸钠质量分数。
①乙同学是通过氧气的质量计算出过碳酸钠的质量,乙同学计算过程中,需要选用氧气的密度;
②两位同学的实验结果不同,经分析乙同学实验方案正确。甲同学的实验方案不准确的原因是甲称得1.1 g Na2SO4的质量由Na2CO4和Na2CO3与稀硫酸共同反应而生成,使得测定结果不准确。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如右图),为确认其中的溶质,同学们进行了如下的探究活动。请你参与到其中去,回答有关问题。

【进行猜想】猜想Ⅰ:该溶液的溶质是NaCl;
猜想Ⅱ:该溶液的溶质是NaOH;
猜想Ⅲ:该溶液的溶质是Na2CO3;
猜想IV:该溶液的溶质是NaHCO3.
【查阅资料】常温下物质的相关信息如下表:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
从物质的相关信息可知,该溶液的溶质不是NaHCO3,因为常温下NaHCO3溶液溶质的质量分数最大是
(精确到01.%)。
【进行实验】
(1)测定溶液的pH大于7,该溶液的溶质不是 (填化学式)。
(2)同学们又进行了如下实验,实验过程如下:

①产生白色沉淀的化学方程式是 。
②实验可以判断原无色溶液中含有的溶质有 。
【获得结论】
该瓶原来装的无色溶液的溶质是NaOH,并且 (填“没有”、“部分”或“全部”)变质。
【拓展】
提纯该无色溶液的步骤是:先向无色溶液中加入适量的 ,然后过滤。反应化学方程式是 。