题目内容
【题目】空气是一种宝贵资源,如利用制得的氢气(H2)和空气中分离出的氮气(N2)合成氨气(NH3),下列是合成氨的工艺流程图:
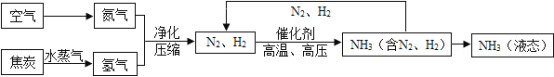
(1)根据上述流程写出氮气与氢气反应生成氨气的文字表达式_____。
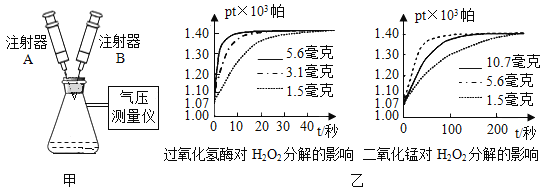
(2)将沸点不同的气体分离开来,常采用液化分离法。如,控制温度在-183℃时,可将空气中氮气与氧气分离,这一过程是_____变化(填“物理”或“化学”)。根据下表中物质的沸点判断,要将产物 NH3与 N2、H2分离开来,温度应该控制在_____以下。
物质 | H2 | N2 | NH3 |
沸点/℃ | -252 | -195.8 | -33.35 |
(3)用“![]() 、
、![]() 、
、![]() ”分别表示 N2、H2、NH3,用“
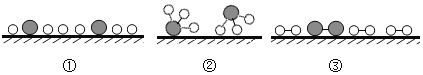
”分别表示 N2、H2、NH3,用“![]() ”表示催化剂,观察下列微观图,合成氨化学反应过程的微观顺序为_____(将下面三张图用序号排列)。
”表示催化剂,观察下列微观图,合成氨化学反应过程的微观顺序为_____(将下面三张图用序号排列)。
(4)上述流程中可以回收利用的物质是_____。
【答案】氮气+氢气![]() 氨气 物理 -33.35℃ ③①② 氮气、氢气(或N2、H2)
氨气 物理 -33.35℃ ③①② 氮气、氢气(或N2、H2)
【解析】
(1)根据已知,可知氮气和氢气反应文字表达式为:氮气+氢气![]() 氨气;
氨气;
(2)根据沸点不同将物质分离,没有生成新物质,是物理变化,观察三种物质沸点可知,氮气与氢气的沸点比氨气低很多,所以只要温度低于氨气沸点,就能把氢气和氮气先分离出来,故温度应控制在-33.35℃以下;
(3)合成氨首先氮气分子和氢气分子破裂为原子,原子重新组合为氨气分子,顺序为③①②;
(4)由流程图可知,可回收利用的是氮气和氢气(或N2、H2)。

练习册系列答案
相关题目