题目内容
【题目】有一包白色粉末,可能是碳酸钠和硫酸钠中的一种和两种,张南和小岗同学想对这包白色粉末的成分进行实验探究,请你帮助两位同学完成如下实验及回答相关问题。
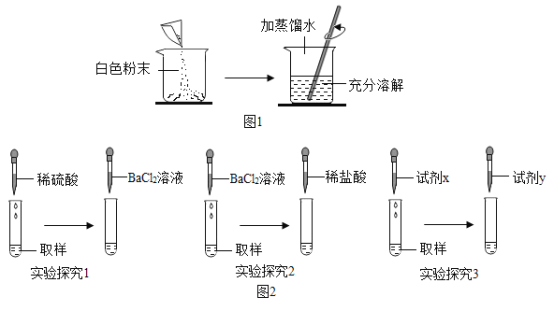
张南和小岗同学首先将白色粉末配成溶液,以下简称“样品”,如图1。
(实验探究1)张南同学取少许于试管中,向此溶液中滴加少量的稀硫酸,发现有气泡产生,发生反应的化学方程式为_____;再向其中加入BaCl2溶液,出现了白色沉淀,他得出白色粉末含有碳酸钠和硫酸钠的结论。
(实验探究2)小岗同学取样品少许于试管中,向试管中滴加足量的 BaCl2溶液,出现了白色沉淀,再向其中滴加少量的稀盐酸,当出现_____的现象。他得出和张南同样的结论,即白色粉末含有碳酸钠和硫酸钠。
(结论与交流)张南和小岗两位同学经过讨论,觉得两个实验都不严谨,不能得出正确的结论。实验探究1,不能得出正确结论的理由是_____。实验探究二的改进方法是_____,张南和小岗两位同学经过讨论,决定进行哪一项验证实验探究。
(实验探究3)张南和小岗两位同学取样品少许于试管中,先向此溶液中滴加_____,再向其中滴加_____,出现了白色沉淀,他得出白色粉末含有碳酸钠和硫酸钠的结论。
(反思与结论)从上述实验得出的经验是:用化学实验的方法验证某种物质的存在,不仅所加试剂与被检验物质发生反应,有明显实验现象,还需要考虑是加试剂_____,才能验证物质的成分。
【答案】Na2CO3+H2SO4═Na2SO4+H2O+CO2↑ 沉淀部分溶解、产生气泡 稀硫酸和碳酸钠反应生成的硫酸钠能和氯化钡反应生成白色沉淀硫酸钡,因此不能确定样品中是否含有硫酸钠 把向其中滴加少量的稀盐酸改为向其中滴加足量的稀盐酸 足量稀盐酸 氯化钡溶液 的量、加入的试剂不能影响待测物质等
【解析】
碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,和稀硫酸反应生成硫酸钠、水和二氧化碳;
氯化钡和碳酸钠反应生成白色沉淀碳酸钡和氯化钠,和硫酸钠反应生成白色沉淀硫酸钡和氯化钠;
碳酸钡和稀盐酸反应生成氯化钡、水和二氧化碳,硫酸钡不溶于稀盐酸、稀硫酸。
【实验探究1】
取少许于试管中,向此溶液中滴加少量的稀硫酸,发现有气泡产生,说明溶液中含有碳酸钠,碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳发生反应的化学方程式为:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑。
故填:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑。
【实验探究2】
取样品少许于试管中,向试管中滴加足量的BaCl2溶液,出现了白色沉淀,再向其中滴加少量的稀盐酸,当沉淀部分溶解、产生气泡时,得出和张南同样的结论,即白色粉末含有碳酸钠和硫酸钠。
故填:沉淀部分溶解、产生气泡。
【结论与交流】
实验探究1,不能得出正确结论的理由是:稀硫酸和碳酸钠反应生成的硫酸钠能和氯化钡反应生成白色沉淀硫酸钡,因此不能确定样品中是否含有硫酸钠;
实验探究二的改进方法是:把向其中滴加少量的稀盐酸改为向其中滴加足量的稀盐酸,加入足量稀盐酸时,如果沉淀部分溶解、产生气泡,溶解的白色沉淀是碳酸钡,不溶解的白色沉淀是硫酸钡,产生的气体是碳酸钡和稀盐酸反应生成的二氧化碳。
故填:稀硫酸和碳酸钠反应生成的硫酸钠能和氯化钡反应生成白色沉淀硫酸钡,因此不能确定样品中是否含有硫酸钠;把向其中滴加少量的稀盐酸改为向其中滴加足量的稀盐酸。
【实验探究3】
张南和小岗两位同学取样品少许于试管中,先向此溶液中滴加足量稀盐酸,产生气泡,说明溶液中含有碳酸钠,再向其中滴加氯化钡溶液,出现了白色沉淀,说明溶液中含有硫酸钠,能够得出白色粉末含有碳酸钠和硫酸钠的结论。
故填:足量稀盐酸;氯化钡溶液。
【反思与结论】
从上述实验得出的经验是:用化学实验的方法验证某种物质的存在,不仅所加试剂与被检验物质发生反应,有明显实验现象,还需要考虑的是加试剂的量、加入的试剂不能影响待测物质等,才能验证物质的成分。
故填:的量、加入的试剂不能影响待测物质等。

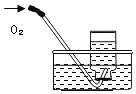
【题目】下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
选项 | A | B | C | D |
实 验 装 置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氢气 |
解释 | 集气瓶中的水:吸收放出的热量 | 量筒中的水:通过水体积的变化得出O2体积 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | 集气瓶中的水:用水将集气瓶内的空气排净后,便于观察O2何时收集满 |
A.AB.BC.CD.D
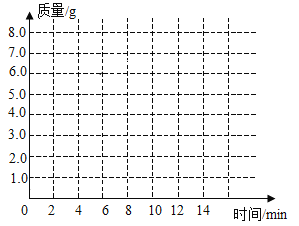
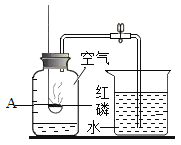
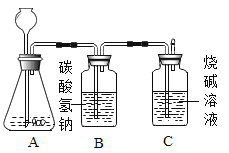
【题目】九年级(三)班化学兴趣小组为测定大理石中碳酸钙的含量,如下图所示:将过量的稀盐酸加入到20 g大理石中(其他成分不与盐酸反应),把产生的CO2气体用足量的烧碱溶液吸收,同时测量C瓶烧碱溶液增加的质量,结果如下表所示:
时间/分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
C增加质量/g | 0 | 3.0 | 5.0 | 6.0 | 6.6 | x | 6.6 |
(1)上表中,第10分钟时,x=______________。
(2)请在下图的坐标纸上,以时间为横坐标,以产生CO2气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线_______;
(3)计算大理石样品中碳酸钙的质量分数_______。
(4)B中所装药品为碳酸氢钠溶液,作用是吸收可能挥发的HC1气体,你认为对测量结果有没有影响_______?