题目内容
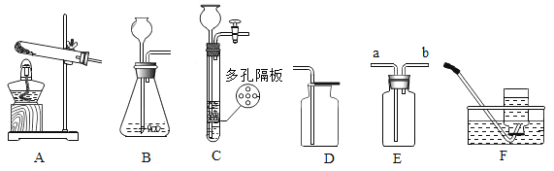
【题目】根据下列实验装置图,回答有关问题
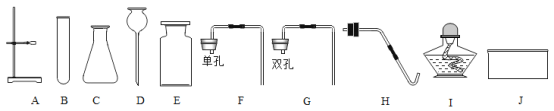
(1)仪器B的名称______________。
(2)写出用高锰酸钾制取氧气的符号表达式___________________,若要制取一瓶纯净的氧气(不考虑水蒸气)你应选择的装置组合是___________(填字母),实验后发现,在装置气密性良好的情况下制得的氧气并不纯,原因可能是___________。
(3)某同学想用过氧化氢溶液和二氧化锰为原料代替高锰酸钾制取一瓶较干燥氧气,她选择的发生装置是ABF,其原因是固体和液体反应且___________,你还可选择的发生装置是___________(填字母),写出该方法制取氧气的符号表达式___________。
(4)图2是化学老师针对图1实验自创新装置。图2的创新实验操作步骤为:先将装置固定在铁架台上,向其中注入250g溶质质量分数为8%的氢氧化钠溶液作为电解液,以增强溶液的导电性,用注射器将电解液注满移液管并倒立在装置的两极,连接好导线,开启直流电源至16V,约4分钟,产生一定量的气体时,关闭电源,随即检验两极产生的气体。请你结合上述图示和操作步骤,回答下列问题:
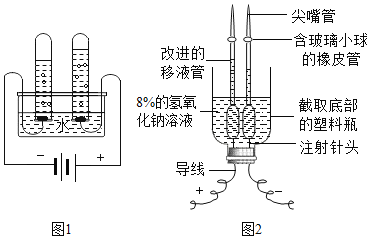
①电解水反应的符号表达式为___________,反应的基本类型为___________。
②你认为图2的创新实验相对图l来说,所具备的优点组合是___________(填字母编号)。
a实验时,手不用直接接触有腐蚀性的电解液
b使用注射针头作电极,两极距离近,反应快
c方便两极气体的检验
d.所用实验器材都是用家里常见的物品改制而成
Aa、b、c Ba、c、d Cb、c、d Da、b、c、d
【答案】试管 KMnO4![]() K2MnO4+MnO2+O2 ABHIEG 集气瓶没有装满水 不需要加热 CF H2O2
K2MnO4+MnO2+O2 ABHIEG 集气瓶没有装满水 不需要加热 CF H2O2![]() H2O+O2 H2O
H2O+O2 H2O![]() H2+O2 分解反应 B
H2+O2 分解反应 B
【解析】
(1)仪器B的名称是试管,故填:试管。
(2)加热高锰酸钾生成锰酸钾、二氧化锰和氧气,符号表达式为:KMnO4![]() K2MnO4+MnO2+O2;高锰酸钾为原料制取氧气需要加热,她选择的发生装置是ABHI;
K2MnO4+MnO2+O2;高锰酸钾为原料制取氧气需要加热,她选择的发生装置是ABHI;
因为氧气的密度比空气大,可以用向上排空气法收集,氧气不易溶于水,可以用排水法收集,用排水法收集的氧气比用排空气法收集的氧气纯净,收集装置是EG;实验后发现,在装置气密性良好的情况下制得的氧气并不纯,原因可能是集气瓶没有装满水;
故填:KMnO4![]() K2MnO4+MnO2+O2;ABHIEG;集气瓶没有装满水。
K2MnO4+MnO2+O2;ABHIEG;集气瓶没有装满水。
(3)某同学想用过氧化氢溶液和二氧化锰为原料代替高锰酸钾制取一瓶较干燥氧气,她选择的发生装置是ABF,其原因是固体和液体反应且不需要加热,你还可选择的发生装置是CF;过氧化氢溶液和二氧化锰制取氧气的符号表达式为:H2O2![]() H2O+O2。
H2O+O2。
故填:不需要加热;CF;H2O2![]() H2O+O2。
H2O+O2。
(4)①电解水时,正极产生的气体是氧气,负极产生的氢气是氢气,反应的符号表达式为H2O![]() H2+O2;该反应的基本类型为分解反应;故填:H2O
H2+O2;该反应的基本类型为分解反应;故填:H2O![]() H2+O2;分解反应。
H2+O2;分解反应。
②使用图2装置实验时,手不用直接接触有腐蚀性的电解液、方便两极气体的检验、所用实验器材都是用家里常见的物品改制而成等优点。但使用注射针头作电极,电极的面积较小,反应较慢,所以B正确。故填:B。

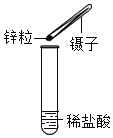
【题目】文文想通过实验测定稀硫酸中硫酸的质量分数,他分四次向182.5g稀硫酸(包含硫酸和水)中加入含有杂质的锌粉(杂质不溶于盐酸也不与盐酸发生反应),记录所加锌粉质量与产生氢气的质量如图。
次数 | 1 | 2 | 3 | 4 |
锌粉质量/g | 5 | 5 | 5 | 5 |
氢气质量/g | M | 0.15 | 0.1 | 0 |
(1)M的数值为.________ 。
(2)请计算稀硫酸中硫酸所占的质量分数_______。
(3)含杂质的锌中锌的质量分数_______。
【题目】(一)小明在实验室观察完品红扩散实验后,想把变红的水做一个简单的处理后再排入下水道。请根据如图相关信息,回答下列问题:
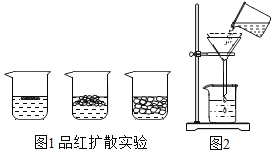
(1)图2过滤操作中必须用到的玻璃仪器分别是______、______、烧杯,请指出该操作过程中的其中两处错误______、______。
(2)小明同学将红色液体按过滤的正确操作完成后,发现过滤后的液体中仍有少量品红固体,则造成这种情况可能的原因是(填一种即可)______
(3)水是一种重要的资源,人类离不开水。在很长一段时期内,人类不了解水到底是由什么组成的。直到18世纪末,人类通过电解水实验才最终认识了水的组成。下列实验也能证明水是由氧元素和氢元素组成的是______(填序号)
A 氢气在氧气中燃烧 B 石蜡在空气中燃烧 C 水的蒸发 D 水的净化
(二)实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的文字表达式:______。
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
(提出猜想)除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂。
(完成实验)按下表进行试验:测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度(℃) |
① | KClO3 | 580 |
② | KClO3、MnO2(质量比1:1) | 350 |
③ | KClO3、CuO(质量比l:1) | 370 |
④ | KClO3、Fe2O3(质量比1:1) | 390 |
(分析数据、得出结论)
(1)由实验______形成对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是______。
(反思)
(1)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后质量和______;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证______。