题目内容
【题目】实验室常用加热氯酸钾与二氧化锰的混合物的方法制取氧气,写出反应的文字表达式: 。
某化学兴趣小组发现:氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】:除二氧化锰、氧化铜外,氧化铁也可以作氯酸钾分解的催化剂。
【完成实验】按下表进行实验,并测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验用品 | 分解温度 |
1 | 3.0g氯酸钾 | 580 |
2 | 3.0g氯酸钾和1.0g二氧化锰 | 350 |
3 | 3.0g氯酸钾和1.0g氧化铜 | 370 |
4 | x g氯酸钾和1.0g氧化铁 | 390 |
【分析数据,得出结论】
(1)实验4中x的值应为 ,由实验 与实验4对比,证明猜想合理
(2)实验所用的三种物质中,催化效果最好的是 。
【反思】若要证明氧化铁是该反应的催化剂,还要验证它在化学反应前后的 和 不变。
【继续探究】小组同学完成上述实验后,又深一步进行“氧化铜用量与一定质量氯酸钾制取氧气反应速率关系”的探究,下表是他们的有关实验数据,请你回答有关问题:
氧化铜与氯酸钾的质量比 | 1/40 | 1/20 | 1/10 | 1/5 | 1/3 | 1/2 | 2/3 | 1/1 | 2/1 |
生成1L氧气所需的时间(s) | 124 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
【分析整理】
(3)据上表可知氧化铜用量过多,产生氧气的速率 (填“变快”、“变慢”或“不变”),氧化铜与氯酸钾的质量比为 时,反应速率最快。
【结论1】在化学反应中催化剂的用量 (填“是”或“不是”)越多越好。
【举一反三】该兴趣小组同学想到了双氧水在二氧化锰催化下制取氧气,又提出问题:双氧水分解速度还和什么因素有关?
【设计并完成实验】
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
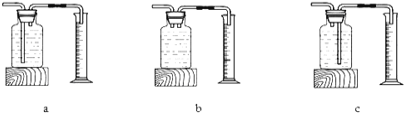
(4)实验中,小组同学安装了下图装置测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素.下列检查该装置气密性的方法中正确的是 .

A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差.
B、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差.
(5)本实验中,还可以选用下列的装置 来代替注射器来测量O2体积
【结论2】在相同条件下,双氧水的 ,双氧水分解得越快。
【答案】氯酸钾![]() 氯化钾+氧气;
氯化钾+氧气;
(1)3.0g;1;
(2)二氧化锰;质量;化学性质;
(3)变慢;1/10;【结论1】不是;
(4)A;
(5)C;【结论2】浓度越大
【解析】
试题分析:氯酸钾在二氧化锰作催化剂下反应的文字表达式为)氯酸钾![]() 氯化钾+氧气;(1)因为控制变量,进行对比,故实验4中x的值应为3.0g,由实验1与实验4对比,证明猜想合理;(2)因为二氧化锰作催化剂,所需要的温度最低,故实验所用的三种物质中,催化效果最好的是二氧化锰;【反思】根据催化剂的定义,若要证明氧化铁是该反应的催化剂,还要验证它在化学反应前后的质量和化学性质在发生化学变化前后是否改变;(3)据上表可知氧化铜用量过多,产生氧气的速率变慢氧化铜与氯酸钾的质量比为1/10时,反应速率最快,【结论1】在化学反应中催化剂的用量不是越多越好;(4)检验装置气密性的方法将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差,故选择A;(5)本实验中,还可以选用C装置,代替注射器,已测量气体体积;【结论2】在相同条件下,双氧水的浓度越大分解得越快。
氯化钾+氧气;(1)因为控制变量,进行对比,故实验4中x的值应为3.0g,由实验1与实验4对比,证明猜想合理;(2)因为二氧化锰作催化剂,所需要的温度最低,故实验所用的三种物质中,催化效果最好的是二氧化锰;【反思】根据催化剂的定义,若要证明氧化铁是该反应的催化剂,还要验证它在化学反应前后的质量和化学性质在发生化学变化前后是否改变;(3)据上表可知氧化铜用量过多,产生氧气的速率变慢氧化铜与氯酸钾的质量比为1/10时,反应速率最快,【结论1】在化学反应中催化剂的用量不是越多越好;(4)检验装置气密性的方法将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差,故选择A;(5)本实验中,还可以选用C装置,代替注射器,已测量气体体积;【结论2】在相同条件下,双氧水的浓度越大分解得越快。