题目内容
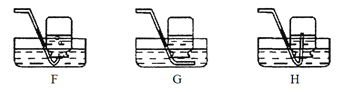
【题目】氧气是一种化学性质比较活泼的气体,它可以和许多物质发生化学反应。如图所示是硫粉、红磷、细铁丝在氧气中燃烧的实验装置:

(1)小李是个善于思考、善于总结的同学。做完实验后,他发现了一些共同点:在反应条件方面,三个实验都要 ,在反应类型方面,三个化学反应都是 反应(填基本反应类型)。
(2)小强同时也总结出在生成物的种类、生成物的状态和观察到的实验现象三个方面存在不同。请你替小明同学填写空格:
甲中反应的文字表达式是 。
丙中观察到的反应现象是 。
(3)如果丙实验过程中未看到“火星四射”的现象的可能原因有(至少写两种)
①_______ ___②___________ ___。
(4)写出铁丝在氧气中燃烧的文字表达式________ _______。
(5)小强还总结出:三个实验的集气瓶底部都放有少量水,其中甲集气瓶底部放少量水的目的是 。
丙集气瓶底部放少量水的目的是 。
【答案】(1)点燃 化合(2)硫+氧气![]() 二氧化硫 剧烈燃烧,火星四射,生成黑色固体(3)氧气浓度太低 铁丝生锈等(4)铁+氧气
二氧化硫 剧烈燃烧,火星四射,生成黑色固体(3)氧气浓度太低 铁丝生锈等(4)铁+氧气![]() 四氧化三铁(5)吸收二氧化硫气体,防止二氧化硫逸出,污染空气 防止炽热的生成物溅落下来炸裂瓶底
四氧化三铁(5)吸收二氧化硫气体,防止二氧化硫逸出,污染空气 防止炽热的生成物溅落下来炸裂瓶底
【解析】
试题分析:根据题中的表示可知,(1)在反应条件方面,三个实验都要点燃,在反应类型方面,三个化学反应都是化合反应;(2)甲中反应的文字表达式是硫+氧气![]() 二氧化硫,丙中观察到的反应现象是剧烈燃烧,火星四射,生成黑色固体;(3)如果丙实验过程中未看到“火星四射”的现象的可能原因有①氧气浓度太低,②铁丝生锈等;(4) 铁丝在氧气中燃烧的文字表达式铁+氧气
二氧化硫,丙中观察到的反应现象是剧烈燃烧,火星四射,生成黑色固体;(3)如果丙实验过程中未看到“火星四射”的现象的可能原因有①氧气浓度太低,②铁丝生锈等;(4) 铁丝在氧气中燃烧的文字表达式铁+氧气![]() 四氧化三铁;(5) 三个实验的集气瓶底部都放有少量水,其中甲集气瓶底部放少量水的目的是吸收二氧化硫气体,防止二氧化硫逸出,污染空气,丙集气瓶底部放少量水的目的是防止炽热的生成物溅落下来炸裂瓶底。
四氧化三铁;(5) 三个实验的集气瓶底部都放有少量水,其中甲集气瓶底部放少量水的目的是吸收二氧化硫气体,防止二氧化硫逸出,污染空气,丙集气瓶底部放少量水的目的是防止炽热的生成物溅落下来炸裂瓶底。

【题目】按照体积计算空气中氧气约占 %,某化学兴趣小组的同学按照课本的实验装置做“测定空气中氧气的体积分数”实验(图1),但测出的氧气体积分数明显偏小.请你参与探究:

【提出问题】
造成误差的原因是什么?如何改进课本实验装置?
【查阅资料】
①
颜色、状态 | 熔点/℃ | 燃烧所需最低温度/℃ | 密度/gcm﹣3 | |
红磷 | 暗红色固体 | 590 | 240 | 2.34 |
白磷 | 白色固体 | 44.1 | 40 | 1.82 |
②二氧化碳气体能被氢氧化钠溶液吸收
③在加热的条件下铜粉能与氧气反应生成黑色的氧化铜固体
【猜 想】
甲同学:可能是导管内原存有空气,后来留有吸入的水,影响实验的准确性;
乙同学:可能是瓶内残留气体中还有氧气的缘故;
你还能做的猜想是 (写一点即可)。
【交流与讨论】
(1)写出图1中集气瓶中发生反应的文字表达式 ;
(2)丙同学认为,用木炭代替红磷也能完成图1的实验,但事先要在集气瓶中放入一定量的 ;

(3)他们对图1实验装置进行了如图2的改进.
①甲同学提出应把红磷更换为白磷,理由是 ;
②通过粗铜丝来点燃玻璃管内的白磷,利用了金属铜的 性;
③与图1实验装置相比,图2装置的一个优点是 ;
【探究与反思】
(1)为验证乙同学的猜想,将铜粉在残余气体中加热,观察到铜粉变黑,所以乙同学的猜想 (选填“合理”或“不合理”);
(2)大家采用改进的实验装置(图2)进行实验(左边玻璃管上面的空气平均分成了5等份,并标刻度线),待玻璃管冷却、管内白色的烟幕消失,同时能观察到 ,得到了较准确的数据,但又意外发现左玻璃管内壁上端附着白色固体.左玻璃管上端的白色固体主要成分可能是 。
【题目】实验室常用加热氯酸钾与二氧化锰的混合物的方法制取氧气,写出反应的文字表达式: 。
某化学兴趣小组发现:氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】:除二氧化锰、氧化铜外,氧化铁也可以作氯酸钾分解的催化剂。
【完成实验】按下表进行实验,并测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验用品 | 分解温度 |
1 | 3.0g氯酸钾 | 580 |
2 | 3.0g氯酸钾和1.0g二氧化锰 | 350 |
3 | 3.0g氯酸钾和1.0g氧化铜 | 370 |
4 | x g氯酸钾和1.0g氧化铁 | 390 |
【分析数据,得出结论】
(1)实验4中x的值应为 ,由实验 与实验4对比,证明猜想合理
(2)实验所用的三种物质中,催化效果最好的是 。
【反思】若要证明氧化铁是该反应的催化剂,还要验证它在化学反应前后的 和 不变。
【继续探究】小组同学完成上述实验后,又深一步进行“氧化铜用量与一定质量氯酸钾制取氧气反应速率关系”的探究,下表是他们的有关实验数据,请你回答有关问题:
氧化铜与氯酸钾的质量比 | 1/40 | 1/20 | 1/10 | 1/5 | 1/3 | 1/2 | 2/3 | 1/1 | 2/1 |
生成1L氧气所需的时间(s) | 124 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
【分析整理】
(3)据上表可知氧化铜用量过多,产生氧气的速率 (填“变快”、“变慢”或“不变”),氧化铜与氯酸钾的质量比为 时,反应速率最快。
【结论1】在化学反应中催化剂的用量 (填“是”或“不是”)越多越好。
【举一反三】该兴趣小组同学想到了双氧水在二氧化锰催化下制取氧气,又提出问题:双氧水分解速度还和什么因素有关?
【设计并完成实验】
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
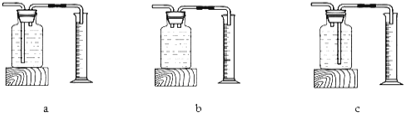
(4)实验中,小组同学安装了下图装置测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素.下列检查该装置气密性的方法中正确的是 .

A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差.
B、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差.
(5)本实验中,还可以选用下列的装置 来代替注射器来测量O2体积
【结论2】在相同条件下,双氧水的 ,双氧水分解得越快。