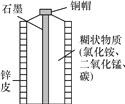
题目内容
【题目】五水硫酸铜(化学式:CuSO4·5H2O)也被称作硫酸铜晶体,在电镀、印染、颜料、农药、医药等方面有广泛应用。
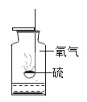
(1)游泳池中的水常显蓝色,是因为向其中洒入了一些硫酸铜晶体,其目的是_____。
(2)农药波尔多液的化学制备原理是硫酸铜与熟石灰发生反应,生成的碱式硫酸铜,具有很强的杀菌能力。Ca(OH)+2CuSO=X+Cu(OH)SO4↓,请写出X的化学式_____。
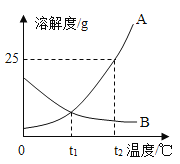
(3)依据下表中硫酸铜的溶解度数据,若要从溶液中得到硫酸铜晶体较好的方法是_____。
(4)硫酸铜晶体在加热时会逐步失去结晶水直至完全失去结晶水变成白色无水物。请根据所给图像,写出从45℃到110℃发生反应的化学方程式_____。
硫酸铜在不同温度下的溶解度
温度 | 0 | 10 | 20 | 30 | 40 | 50 |
溶解度S/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 |
温度℃ | 60 | 70 | 80 | 90 | 100 | |
溶解度S/g | 40.0 | 47.1 | 55 | 64.2 | 75.4 |

(5)由黄铜矿(CuFeS2)制取硫酸铜晶体有以下两种方法:
传统法:①焙烧 ②稀硫酸酸浸 ③除杂 ④结晶 ⑤甩干
改进法:①浓硫酸酸浸 ②水溶 ③除杂 ④结晶 ⑤甩干
(问题1)两种工艺中除杂时都要适当调高pH值以更好地除去其中的铁元素,下列加入的物质能达到此目的的是_____。
A Cu B CuO C NaOH D Cu(OH)2
(问题2)水溶时,加入的水量不宜太多。一是为了考虑节约原料,二是为了_____。
(问题3)除杂后过滤出滤液时,要趁热过滤的原因是_____。
(问题4)最后一步干燥时,选择甩干而不选择常用的烘干,理由是_____
(问题5)改进法与传统法相比,你认为最大的优点是_____。
【答案】杀菌消毒 CaSO4 降温结晶 ![]() C 节约结晶所需时间 在温度高时,硫酸铜的溶解度较大 硫酸铜晶体受热易分解 环保、无污染
C 节约结晶所需时间 在温度高时,硫酸铜的溶解度较大 硫酸铜晶体受热易分解 环保、无污染
【解析】
(1)硫酸铜溶液呈蓝色,具有杀菌消毒的作用;
(2)由质量守恒定律可知,化学反应前后原子的种类与数目不变,反应前有:1个钙原子、10个氧原子、2个氢原子、2个铜原子、2个硫原子;反应后有:2个铜原子、2个氢原子、1个硫原子和6个氧原子,所以X中含有1个钙原子、1个硫原子和4个氧原子,即X的化学式为CaSO4;
(3)由表格中的数据可知,硫酸铜的溶解度受温度影响较大,所以可采用降温结晶的方法得到硫酸铜晶体;
(4)25.0g五水硫酸铜(化学式:CuSO45H2O)中含硫酸铜的质量为:![]() ,则含结晶水的质量为:25.0g-16.0g=9.0g(5个结晶水的质量,则每个结晶水的质量为
,则含结晶水的质量为:25.0g-16.0g=9.0g(5个结晶水的质量,则每个结晶水的质量为![]() ;45℃时晶体的质量为21.4g,晶体质量减少了:25.0g-21.4g=3.6g,即减少了:3.6g÷1.8g=2个结晶水,所以45℃时晶体的化学式为CuSO43H2O;110℃时晶体的质量为:17.8g,减少了25.0g-17.8g=7.2g,即减少了:7.2g÷1.8g=4个结晶水,所以110℃时晶体的化学式为CuSO4H2O;则从45℃到110℃发生反应的化学方程式为:
;45℃时晶体的质量为21.4g,晶体质量减少了:25.0g-21.4g=3.6g,即减少了:3.6g÷1.8g=2个结晶水,所以45℃时晶体的化学式为CuSO43H2O;110℃时晶体的质量为:17.8g,减少了25.0g-17.8g=7.2g,即减少了:7.2g÷1.8g=4个结晶水,所以110℃时晶体的化学式为CuSO4H2O;则从45℃到110℃发生反应的化学方程式为:![]()
(5)[问题1]两种工艺中除杂时都要适当调高pH值以更好地除去其中的铁元素,加入氢氧化钠能达到此目的,因为铜与酸不反应,既不能调大pH,也不能除去铁元素;氧化铜和氢氧化铜不能除去铁元素;
[问题2]水溶时,加入的水量不宜太多。一是为了考虑节约原料,二是为了节约结晶所需时间;
[问题3]因为在温度高时,硫酸铜的溶解度较大,所以除杂后过滤出滤液时,要趁热过滤;
[问题4]因为硫酸铜晶体受热易分解,所以最后一步干燥时,选择甩干而不选择常用的烘干;
[问题5]传统法在焙烧时会产生二氧化硫气体而造成空气污染,而该进法没有产生二氧化硫,所以改进法与传统法相比,最大的优点是环保、无污染。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
实验 | A | B | C | D |
装置 |
|
|
|
|
解释 | 集气瓶中的水:吸 收放出的热量 | 量筒中的水:通过水 的体积变化得出 O2 的体积 | 集气瓶中的水:冷 却溅落熔融物,防 止集气瓶炸裂 | 集气瓶中的水:水 先将集气瓶内的空 气排净 |
A. A B. B C. C D. D
【题目】碳酸钠和碳酸氢钠是生活中常见的盐,通过实验验证、探究它们的化学性质.
(查阅资料)
①Na2CO3+CaCl2═CaCO3↓+2NaCl
②2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
③Ca(HCO3)2 易溶于水.
④CaCl2 溶液分别与 NaHCO3、Na2CO3 溶液等体积混合现象(表中的百分数为溶液中溶质的质量分数):
NaHCO3 | Na2CO3 | ||||
0.1% | 1% | 5% | 0.1% | ||
CaCl2 | 0.1% | 无明显现象 | 有浑浊 | 有浑浊 | 有浑浊 |
1% | 无明显现象 | 有浑浊 | 有浑浊,有微小气泡 | 有沉淀 | |
5% | 无明显现象 | 有浑浊 | 有沉淀,有大量气泡 | 有沉淀 | |
(进行实验)
序号 | 实验装置 | 主要实验步骤 | 实验现象 |
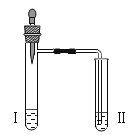
实验 1 |
| 向2支试管中分别加入少 量Na2CO3 和 NaHCO3 溶液,再分别滴加盐酸 | 2 |
实验 2 |
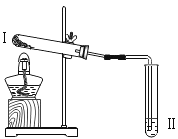
| 向Ⅱ中加入试剂a,向Ⅰ中 加入少量Na2CO3或 NaHCO3 固体,分别加热一段时间 | Na2CO3 受热时Ⅱ中无明 显现象 NaHCO3 受热时Ⅱ中出现浑浊 |
实验 3 |
| 向Ⅱ中加入试剂 a,向Ⅰ中 加入少量 5%的 NaHCO3 溶 液,再滴加 5%的 CaCl2 溶 液 | Ⅰ中出现浑浊,有气泡产 生Ⅱ中出现浑浊 |
(解释与结论)
(1)实验1中,NaHCO3与盐酸反应的化学方程式为_____.
(2)实验2中,试剂a为_____.
(3)实验3中,NaHCO3 与 CaCl2 反应的化学方程式为:2NaHCO3+CaCl2═_____+_____+_____+H2O
(反思与评价)
(1)实验 2 中,加热 NaHCO3后,试管Ⅰ中残留固体成分可能为_____(写出所有可能).
(2)资料④中,NaHCO3溶液与 CaCl2 溶液混合的现象中,有些只观察到浑浊、未观察到气泡,原因可能是_____.
(3)用2种不同的方法鉴别Na2CO3和NaHCO3 固体,实验方案分别为:
①_____.
②_____.