题目内容
【题目】碳是人类接触最早、利用最多的元素之一。而能源和环境一直受到人们关注。
(1)太阳能和天然气中属于属于不可再生能源的是_______________,天然气的主要成分是CH4,CH4中H的质量分数为_____________。CH4燃烧主要是将化学能转化为_____________能。
(2)造成大气中CO2含量增加的主要原因是_______________。(填序号)
A动植物的呼吸作用 B实验室逸出CO2 C化石燃料的大量燃烧
(3)汽车尾气中含有有毒的CO和NO,这两种气体可在催化剂作用下转化为CO2和N2,该反应中CO和NO的分子个数比为________________。
(4)坚硬无比的金刚石,柔软易碎的石墨,还有神秘的C60都是由碳元素组成的__________(填“单质”或“化合物”)。
(5)市场上出售的椰壳活性炭是以椰子壳为原料,经过一系列生产工艺精细加工而成。它具有疏松多孔的结构,具有极强的____________性,可以用于除去装修产生的有害气体。
(6)书画《富春山居图》是元朝画家黄公望的代表作,此图能够保存至今而不变色的原因是_______________。
【答案】天然气 25% 热能 C 1:1 单质 吸附 常温下,碳的化学性质稳定
【解析】
(1)天然气在短时间不能形成,属于不可再生能源,太阳能属于可再生能源;甲烷中氢元素的质量分数为:![]() ×100%=25%;甲烷燃烧主要是将化学能转化为热能;
×100%=25%;甲烷燃烧主要是将化学能转化为热能;
(2)大量燃烧化石燃料,可产生大量的二氧化碳,是大气中二氧化碳含量增加的主要原因,故选C;
(3)在催化剂的作用下能使尾气中的CO和NO转化为N2和CO2,反应的化学方程式为:2CO+2NO N2+2CO2,该反应中CO和NO的分子个数比为1:1;
N2+2CO2,该反应中CO和NO的分子个数比为1:1;
(4)金刚石、石墨、C60都属于由碳元素组成的纯净物,都属于单质;
(5)椰壳活性炭具有疏松多孔的结构,具有极强的吸附性,可以用于除去装修产生的有害气体;
(6)碳是组成墨的最主要的元素,因此书画长久不变色的原因就是由于单质碳在常温下的化学性质稳定。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】下表是![]() 和
和![]() 在不同温度时的溶解度,回答问题。
在不同温度时的溶解度,回答问题。
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g |
| 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 | |
I.两种物质中,溶解度受温度影响变化较大的是_____。
II.除去![]() 中少量的
中少量的![]() ,步骤是:加水溶解,蒸发浓缩,_____,过滤,洗涤,干燥。
,步骤是:加水溶解,蒸发浓缩,_____,过滤,洗涤,干燥。
III.50℃时,将两种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到50℃,剩余溶液的质量:![]() 溶液_____(填“大于”、“等于”或“小于”)
溶液_____(填“大于”、“等于”或“小于”)![]() 溶液。
溶液。
IV.![]()

A中溶液_____(填“饱和”或“不饱和”)溶液,C中溶液的总质量是_____g。
【题目】五水硫酸铜(化学式:CuSO4·5H2O)也被称作硫酸铜晶体,在电镀、印染、颜料、农药、医药等方面有广泛应用。
(1)游泳池中的水常显蓝色,是因为向其中洒入了一些硫酸铜晶体,其目的是_____。
(2)农药波尔多液的化学制备原理是硫酸铜与熟石灰发生反应,生成的碱式硫酸铜,具有很强的杀菌能力。Ca(OH)+2CuSO=X+Cu(OH)SO4↓,请写出X的化学式_____。
(3)依据下表中硫酸铜的溶解度数据,若要从溶液中得到硫酸铜晶体较好的方法是_____。
(4)硫酸铜晶体在加热时会逐步失去结晶水直至完全失去结晶水变成白色无水物。请根据所给图像,写出从45℃到110℃发生反应的化学方程式_____。
硫酸铜在不同温度下的溶解度
温度 | 0 | 10 | 20 | 30 | 40 | 50 |
溶解度S/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 |
温度℃ | 60 | 70 | 80 | 90 | 100 | |
溶解度S/g | 40.0 | 47.1 | 55 | 64.2 | 75.4 |

(5)由黄铜矿(CuFeS2)制取硫酸铜晶体有以下两种方法:
传统法:①焙烧 ②稀硫酸酸浸 ③除杂 ④结晶 ⑤甩干
改进法:①浓硫酸酸浸 ②水溶 ③除杂 ④结晶 ⑤甩干
(问题1)两种工艺中除杂时都要适当调高pH值以更好地除去其中的铁元素,下列加入的物质能达到此目的的是_____。
A Cu B CuO C NaOH D Cu(OH)2
(问题2)水溶时,加入的水量不宜太多。一是为了考虑节约原料,二是为了_____。
(问题3)除杂后过滤出滤液时,要趁热过滤的原因是_____。
(问题4)最后一步干燥时,选择甩干而不选择常用的烘干,理由是_____
(问题5)改进法与传统法相比,你认为最大的优点是_____。
【题目】(9分)CO2通入NaOH溶液中没有明显现象,CO2与NaOH是否发生了化学反应呢?某化学兴趣小组的同学们对此进行了探究。
【查阅资料】①通常情况下,1体积水溶解1体积的CO2。
②在一定浓度的溶液中,有微溶物生成的复分解反应也能发生。
【实验探究】小红同学设计了下图所示的实验装置(锥形瓶内充满CO2),并进行实验。
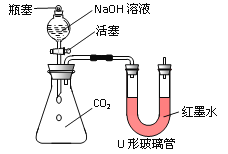
打开瓶塞和活塞,使NaOH溶液快速滴入锥形瓶中,立即关闭活塞(漏斗中仍有溶液剩余),观察到U形管左侧的红墨水液面______(填“升高”、“降低”或“不移动”),小红根据现象判断CO2和NaOH发生了反应,理由是___________。请根据初中化学知识写出CO2与NaOH溶液反应的化学方程式:____________。
【反思与评价1】小明认为小红的实验方案不严密,理由是_______________________。
【拓展实验】兴趣小组的同学们为此又设计了下表所示的两种方法,进一步探究。请填写表中的空格。
实验方法 | 操作过程 | 现象 | 实验结论 |
方法一 | 取小红实验后锥形瓶内的溶液适量,加入足量CaCl2溶液 | 有白色沉淀生成 | CO2与NaOH发生了反应 |
方法二 | 取小红实验后锥形瓶内的溶液适量,加入足量稀硫酸 | ______________ |
【反思与评价2】同学们经过讨论,认为【拓展实验】的______(填“方法一”或“方法二”)依然不严密,理由是___________________________(用化学方程式表示)。
【题目】某研究小组对过氧化氢溶液制取氧气进行如下探究。
实验一:氧气的性质实验
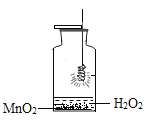
(1)如图所示是铁丝在氧气中燃烧的改进实验,用适量双氧水和二氧化锰代替原实验中集气瓶里的水。
①用双氧水和二氧化锰代替原集气瓶里的水,其优点除了使实验更简便外,还有________
②实验中可观察到到铁丝燃烧的现象是 ________,反应的文字表达式为 ________。
实验二:探究 H2O2 质量分数、溶液 pH、温度对反应速率的影响
(2)设计如下表实验方案:
实验序号 | H2O2 质量分 数/% | pH | 温度/ ℃ | 每分钟气泡数 |
1 | 30 | 5 | 20 | |
2 | 30 | 6 | 20 | |
3 | 30 | 11 | 20 | |
4 | 15 | 11 | 30 | |
5 | a | 11 | b |
①实验 1-3 的实验目的是________。
②a= ________;b= ________。
实验三:探究制取氧气的适宜催化剂
(3)实验方案如下:
I.用 MnO2、CuO、Fe2O3、Cr2O3 四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
II.取 30 粒含 MnO2 的海藻酸钠微球,采用下图装置进行实验。改用其他三种微球,分别重复上述实验,得到下图的锥形瓶内压强随时间变化的曲线图。
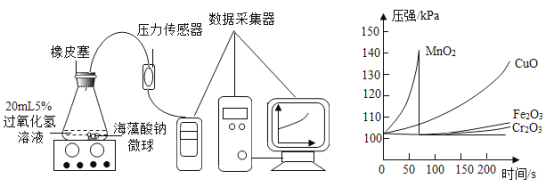
①每次实验时,海藻酸钠微球数应相同的原因________。
②用含 MnO2 的海藻酸钠微球进行实验,60s 时压强瞬间回落,其原因是________
③从实验曲线看,催化效果较好、反应温和的催化剂是________。