题目内容
【题目】A、B、C 三种固体物质在水中的溶解度曲线如图 1 所示,请回答:
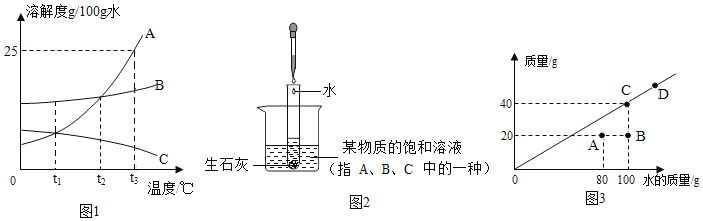
①_____℃时,A、B 两种物质溶解度相等;
②t3℃时恰好溶解掉等质量的 A、B、C 三种物质,所消耗的水最多的是_____;
③若将 t3℃三种物质的饱和溶液分别降温 t1℃时,则对三种溶液的说法正确 的是_____;
A 溶剂质量:C>B>A B 都是饱和溶液
C 溶质质量分数:B>A>C D 析出溶质的质量:B>A>C
④图 2 所示,向盛有生石灰的试管中加入适量水,反应的化学方程式 是_____。实验时,烧杯中有固体析出,判断该饱和溶 液中析出的晶体是_____(填 A 或 B 或 C)。
⑤常温时,某物质在不同质量的水中溶解达到饱和状态,溶质的质量与水的质量关系如图所示。
a.常温时,该物质的溶解度是_____
b.A 点时,该溶液的溶质质量分数为_____
c.图中 A、B、C、D 四个点表示的溶液中溶质质量分数从大到小的关系是_____
⑥向不同温度的 100g 水中分别放入等质量的某物质,保持温度不变,溶解情况如图4所示。相关分析正确的是_____。
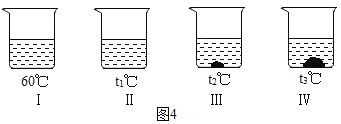
a.溶液温度:Ⅰ>Ⅱ>Ⅲ>Ⅳ
b.溶液质量:Ⅰ=Ⅱ>Ⅲ>Ⅳ
c.溶液Ⅰ一定是不饱和溶液
d.使Ⅳ中的固体全部溶解,溶质质量分数可能不变
【答案】t2 C C CaO+H2O=Ca(OH)2 C 40g 20% C=D>A>B bd
【解析】
①在t2℃时,A、B 两种物质溶解度相等;
②t3℃时恰好溶解掉等质量的 A、B、C 三种物质,所消耗的水最多的是C,因为在该温度下C的溶解度最小;
③若将t3℃三种物质的饱和溶液分别降温t1℃时,则对三种溶液的说法正确的是溶质质量分数:B>A>C,因为C的质量分数不变,还是最小;
④图2所示,向盛有生石灰的试管中加入适量水生成氢氧化钙,同时放出大量的热,反应的化学方程式是:CaO+H2O=Ca(OH)2;实验时,烧杯中有固体析出,判断该饱和溶液中析出的晶体是C,因为C的溶解度随温度升高而降低;
⑤常温时,某物质在不同质量的水中溶解达到饱和状态,溶质的质量与水的质量关系如图3所示;a、常温时,该物质的溶解度是40g;
b、A 点时,该溶液的溶质质量分数=![]()
![]() 100%=20%;
100%=20%;
c、图中 A、B、C、D 四个点表示的溶液中溶质质量分数从大到小的关系是:C=D>A>B;⑥向不同温度的100g水中分别放入等质量的某物质,保持温度不变,溶解情况如图4所示;由于某物质的溶解度随温度变化情况未知,则相关分析正确的是:b、溶液质量:Ⅰ=Ⅱ>Ⅲ>Ⅳ;d、采用增加溶剂的方法使Ⅳ中的固体全部溶解,溶质质量分数可能不变。