题目内容
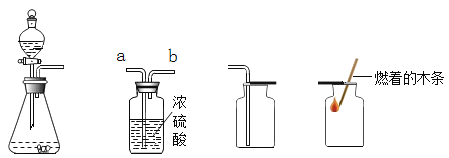
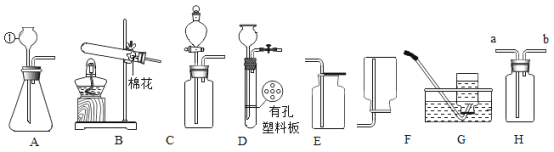
【题目】如图是实验室制取气体时常用的装置、根据装置回答下列问题:
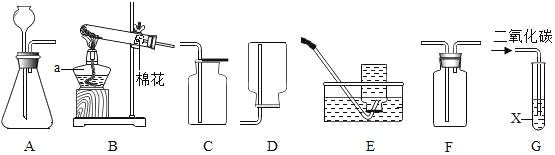
(1)仪器a的名称是____。
(2)实验室用高锰酸钾制取氧气的发生装置是____(填装置编号,下同)。其反应的化学方程式为____,某同学利用装置E收集气体,但所收集的气体不纯,那么他可能的错误操作是____。用双氧水和二氧化锰来制取氧气时,可选用的发生装置是____(填序号,下同),化学方程式为____。可选用C装置收集氧气,其原因是____。
(3)实验室制取二氧化碳的化学方程式为____,收集装置是____;若用F装置收集二氧化碳,二氧化碳气体应该从____(填“长”或“短”)导管导入。
(4)图G中,若X是石蕊试液,可观察现象是____,原因____(用化学方程式表示)。
【答案】酒精灯 B ![]() 未等导管口有连续均匀的气泡冒出时就开始收集 A
未等导管口有连续均匀的气泡冒出时就开始收集 A  氧气的密度比空气密度大 CaCO3+2HCl=CaCl2+H2O+CO2↑ C 长 G中的液体X变红 CO2+H2O=H2CO3
氧气的密度比空气密度大 CaCO3+2HCl=CaCl2+H2O+CO2↑ C 长 G中的液体X变红 CO2+H2O=H2CO3
【解析】
(2)气体的发生装置的选择由反应物状态和反应条件共同决定,据此分析实验室制取氧气的发生装置;
(3)收集密度比空气密度大的且与空气成分不反应的气体应采用向上排空气法,据此分析;
(4)酸性物质能够使石蕊试液变红。
(1)根据图B中仪器a的形状及用途可知,仪器a的名称是酒精灯;
(2)实验室中利用高锰酸钾受热分解制取氧气,该反应需要加热,反应物为固体,因此该反应的发生装置为固体加热型,因此装置中含有酒精灯,所以选用的发生装置为B,高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,则该反应的化学方程式为:![]() ;装置E为排水法收集气体的装置,某同学利用装置E收集气体,但所收集的气体不纯,可能是由于他没有等导管口有连续均匀的气泡冒出时就开始收集,因此收集到的气体中含有装置内残留的空气;双氧水在二氧化锰的催化作用下分解生成氧气和水,该反应不需要加热,因此该反应的发生装置为A,该反应的化学方程式为
;装置E为排水法收集气体的装置,某同学利用装置E收集气体,但所收集的气体不纯,可能是由于他没有等导管口有连续均匀的气泡冒出时就开始收集,因此收集到的气体中含有装置内残留的空气;双氧水在二氧化锰的催化作用下分解生成氧气和水,该反应不需要加热,因此该反应的发生装置为A,该反应的化学方程式为 ,氧气的密度比空气密度大,因此可以采用向上排空气法收集氧气,所以可以采用装置C收集氧气;
,氧气的密度比空气密度大,因此可以采用向上排空气法收集氧气,所以可以采用装置C收集氧气;
(3)实验室中利用大理石或石灰石与稀盐酸反应制取二氧化碳,大理石、石灰石的主要成分是CaCO3,CaCO3与稀盐酸反应生成CaCl2、CO2、H2O,则该反应的化学方程式为CaCO3+HCl=CaCl2+H2O+CO2↑;若用F装置收集二氧化碳,由于二氧化碳的密度比空气密度大,所以应采用向上排空气法收集二氧化碳,因此,二氧化碳气体应该从长导管进,从短导管出;
(4) 图G中,若X是石蕊试液,通入二氧化碳后,二氧化碳与水反应生成碳酸,碳酸能够使石蕊试液变红,因此可观察到的现象是G中的液体X变红,二氧化碳与水反应生成碳酸的化学方程式为CO2+H2O=H2CO3。

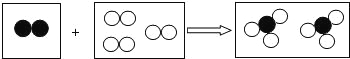
【题目】在一密闭容器里放入四种物质,使其在一定条件下充分反应,测得数据如下:
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/ | 25 | 15 | 1 | 5 |
反应后质量/ | 11 | 未测 | 1 | 22 |
则下列表述正确的是( )
A.未测值为2B.丙可能是催化剂
C.乙全部发生了反应D.甲与乙反应的质量比为![]()
【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验(图一)。
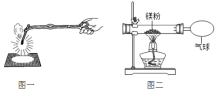
(1)请写出镁条与氧气反应的化学方程式_____________。
(2)经测量发现燃烧产物的质量_______(填“大于”“小于”或“等于”)镁条的质量,分析可知出现这一结果的原因是_________。
(3)兴趣小组按图二装置改进实验后,验证了质量守恒定律,同时发现燃烧产物中有少量黄色固体。
(提出问题)黄色固体是什么呢?
(查阅资料)①氧化镁为白色固体,常温下与水不反应;②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(做出猜想)黄色固体为Mg3N2
(进行实验)同学们通过实验对猜想进行了验证,请你将实验记录表补充完整
实验操作 | 实验现象 | 结论 |
将镁粉燃烧的产物放在一只试管中,加入少量的蒸馏水,然后将一湿润的红色石蕊试纸放在试管口,观察现象 | _______ | 黄色固体 为氮化镁 |
(反思与交流)空气中氮气的含量远大于氧气的含量,而镁条在空气中燃烧生成的氧化镁却远多于氮化镁,是因为 ___________。镁条_________(填“能”或“不能”)代替红磷做测定空气中氧气含量的实验,因为________________。