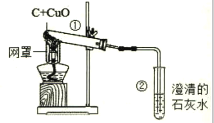
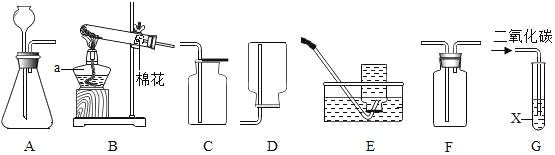
题目内容
【题目】在一密闭容器里放入四种物质,使其在一定条件下充分反应,测得数据如下:
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/ | 25 | 15 | 1 | 5 |
反应后质量/ | 11 | 未测 | 1 | 22 |
则下列表述正确的是( )
A.未测值为2B.丙可能是催化剂
C.乙全部发生了反应D.甲与乙反应的质量比为![]()
【答案】B
【解析】
质量守恒的应用,反应前的总质量等于反应后的总质量。反应前后质量不变可能是杂质或催化剂。
A、根据质量守恒定律,反应前的总质量等于反应后的总质量,可知未测=(25+15+1+5)-(11+1+22)=12,故不符合题意;
B、反应前后质量不变可能是杂质或催化剂,故符合题意;
C、由质量守恒可知乙还有12g,未完全反应,故不符合题意;
D、甲反应的质量=25-11=14g,乙反应的质量=15-12=3g,质量比甲:乙=14:3,故不符合题意。故选B。

 名校课堂系列答案
名校课堂系列答案【题目】下表是NaCl和KNO3物质在不同温度下的部分溶解度数据(单位:g/100g水),请回答问题:
温度(℃) | 10 | 20 | 30 | 40 | 60 |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.3 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 110 |
(1)20℃时,NaCl的溶解度是_____g/100g水;
(2)以上两种物质溶解度变化受温度影响较小的是_____(选填“NaCl”或“KNO3”);
(3)20℃时,将20gNaCl固体加入50g水中,充分搅拌,形成的溶液质量为_____g;
(4)为了将混有少量NaCl杂质的KNO3的饱和溶液提纯,可通过_____方法获得较纯净的KNO3晶体;
(5)40℃时,将NaCl和KNO3的饱和溶液各100g降温到20℃,对剩余溶液描述正确的是_____。
A 溶质的质量分数:NaCl<KNO3
B 析出固体的质量:NaCl>KNO3
C NaCl和KNO3都是饱和溶液
D 溶剂的质量:NaCl>KNO3