题目内容
【题目】有人提出使用“高科技的添加剂”可以使水变成汽油。小明同学在学习过物质构成的奥秘后,认为可以用物质组成的观点解开这个骗局。
(提出问题)根据水的组成和汽油的组成判断,水是否可以变成汽油。
(猜想与验证)
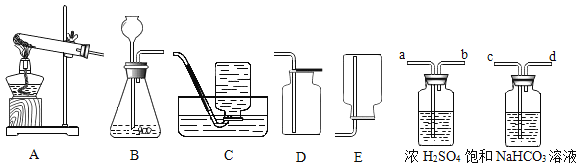
(1)确定水的组成.实验装置示意图如图:
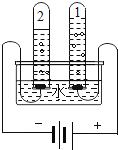
通电一段时间后,试管1和试管2中所收集的气体体积比约为___。对两支试管中的气体进行检验,试管1中的气体可使___(填现象),说明是氧气;实验结论:水是由氢元素和氧元素组成的。
(2)确定汽油的成分。操作如下:
实验步骤 | 实验现象 | 结论 |
①点燃使用汽油作燃料的油灯 ②将光洁干冷的烧杯罩在火焰上方 | 现象:___ | 证明汽油在空气中燃烧后的产物中有水。 |
③将烧杯迅速翻转,注入__,振荡 | 现象:____ | 证明汽油在空气中燃烧后的产物中有二氧化碳。 |
实验结论:汽油的组成中含有___。
【答案】1:2 带火星的木条复燃 澄清石灰水 烧杯内壁有水珠 石灰水变浑浊 碳元素和氢元素
【解析】
(1)据电解水的实验可知,试管1中收集的气体约是试管2中的一半,可知试管1中的气体是氧气,试管2中的气体是氢气,二者体积比约为1:2。氧气有助燃的作用,可使带火星的木条复燃;
(2)汽油燃烧可生成二氧化碳和水,所以罩在点燃的油灯上的干冷烧杯壁内有水珠产生;为证明产物中有二氧化碳,可将内壁蘸有澄清石灰水的烧杯罩在火焰上方,并能看到澄清的石灰水变浑浊。根据实验现象和质量守恒定律可知,汽油的组成中一定有碳元素和氢元素,可以得出本题答案
实验步骤 | 实验现象 | 结论 |
①点燃使用汽油作燃料的油灯; | 现象 | 证明汽油在空气中燃烧后的产物中有 |
③将烧杯迅速翻转,注入澄清石灰水,振荡 | 现象 | 证明汽油在空气中燃烧后的产物中有二氧化碳 |
故答案为:(1)1:2;带火星的木条复燃;
(2)
实验步骤 | 实验现象 | 结论 |
①点燃使用汽油作燃料的油灯; | 现象 | 证明汽油在空气中燃烧后的产物中有水 |
③将烧杯迅速翻转,注入澄清石灰水,振荡 | 现象 | 证明汽油在空气中燃烧后的产物中有二氧化碳 |
[实验结论]碳元素和氢元素

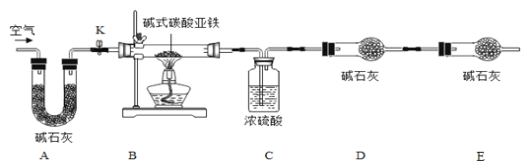
【题目】菱铁矿和赤铁矿一样,也是工业上冶炼铁的一种矿物。某种菱铁矿中铁元素的主要存在形式是碱式碳酸亚铁,为测定碱式碳酸亚铁[xFeCO3yFe(OH)2zH2O]的组成,华雪同在老师的指导下设计了如图实验装置:
(查阅资料)
a.碱式碳酸亚铁受热会完全分解生成FeO、CO2以H2O。
b.FeO是一种黑色粉末,它不稳定,在空气中加热,可被氧化成四氧化三铁。
c.碱石灰是NaOH及CaO的混合物,可以吸收CO2和H2O
(实验步骤)
(1)检查装置的_____后,准备称取3.40g碱式碳酸亚铁粉末放在装置B中,连接仪器。
(2)_____,鼓入一段时间空气,准确称量装置C、D、E的质量。
(3)关闭弹簧夹K,加热装置B至装置C中导管末端无气泡冒出,再打开弹簧夹K,缓缓通空气一段时间,这样操作的目的是_____。
(4)再次准确称量装置C、D、E的质量,所得数据如下
装置C/g | 装置D/g | 装置E/g | |
加热前 | 200.00 | 180.00 | 180.00 |
加热后 | 200.36 | 180.88 | 180.00 |
(5)分析图、表中数据可知:3.40g碱式碳酸亚铁受热分解过程中生成H2O的质量为_____g,CO2的质量为_____g,装置E的作用是_____。
(实验结论)
在xFeCO3yFe(OH)2zH2O中,氢原子与氧原子的个数之比为_____。
(实验反思)
(1)装置A的作用是_____。
(2)实验结束后,装置B中的残留固体可能全部是FeO.也可能全部是Fe3O4.还可能是_____。
(3)为了得到装置B中残留固体的组成,华雪同学称得装置B中残留固体质量为2.24g后,通过计算可知:残留固体的组成及各成分的质量为_____。