题目内容
【题目】某化学兴趣小组欲通过实验测定某种石灰石中碳酸钙的质量分数。取该石灰石样品8.0g,将80mL稀盐酸分四次加入,所得数据如下表(已知该石灰石中的杂质不溶于水,也不与稀盐酸反应):
实验序号 | 1 | 2 | 3 | 4 |
加入稀盐酸的体积(mL) | 20 | 20 | 20 | 20 |
充分反应后剩余固体的质量(g) | 5.5 | m | 1.2 | n |
(1)上表中,m=_____,n=_____。
(2)该石灰石中碳钙的质量分数为_____。
(3)若要制取6.6g二氧化碳,至少需要该石灰石多少克?_____(写出计算过程,结果精确到0.lg)
【答案】3 1.2 85% 17.6g
【解析】
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳。
(1)由表中的数据可知,第1次实验,20g的稀盐酸完全反应固体质量减少![]() ,第2次实验,20g的稀盐酸完全反应固体质量也减少2.5g,故
,第2次实验,20g的稀盐酸完全反应固体质量也减少2.5g,故
![]() ,第3次实验,20g的稀盐酸完全反应剩余固体质量为1.2g,固体减少了1.8g,则第3次实验碳酸钙反应完全,故第4次实验剩余固体质量不再变化,
,第3次实验,20g的稀盐酸完全反应剩余固体质量为1.2g,固体减少了1.8g,则第3次实验碳酸钙反应完全,故第4次实验剩余固体质量不再变化,![]() 。
。
(2)该石灰石中碳酸钙的质量分数为![]()
(3)设至少需要该石灰石的质量为x
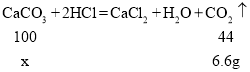
![]()
![]()
故若要制取6.6g二氧化碳,至少需要该石灰石的质量为![]()

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
【题目】在一定条件下,向一密闭的容器内加入A、B、C、D四种物质各20g,充分反应后,测定其质量,得到数据如下:
物质 | A | B | C | D |
反应前质量/g | 20 | 20 | 20 | 20 |
反应后质量/g | 20 | 30 | 未知 | 14 |
(1)反应后C的质量是_____g。
(2)A物质可能是_____(填“反应物”或“生成物”“催化剂”)。
(3)容器中B物质肯定是_____填“单质”或“化合物”)。
(4)容器中发生反应的基本反应类型是_____。