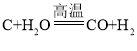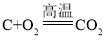题目内容
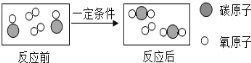
【题目】在一定条件下,向一密闭的容器内加入A、B、C、D四种物质各20g,充分反应后,测定其质量,得到数据如下:
物质 | A | B | C | D |
反应前质量/g | 20 | 20 | 20 | 20 |
反应后质量/g | 20 | 30 | 未知 | 14 |
(1)反应后C的质量是_____g。
(2)A物质可能是_____(填“反应物”或“生成物”“催化剂”)。
(3)容器中B物质肯定是_____填“单质”或“化合物”)。
(4)容器中发生反应的基本反应类型是_____。
【答案】16 催化剂 化合物 化合反应
【解析】
A物质反应前后质量没有变化,可能是催化剂或没有参加反应,B物质反应后质量增加,为生成物,C物质反应后质量减少,为反应物,D物质反应后质量减少,为反应物,,则反应物C和D生成B。
(1)根据质量守恒定律,反应前反应物的总质量等于生成物的总质量,
![]() ,未知=16,反应后C的质量是16g。
,未知=16,反应后C的质量是16g。
(2)催化剂在反应前后质量和化学性质均不变,A物质反应前后质量没有变化,可能是催化剂。
(3)A物质反应前后质量没有变化,可能是催化剂或没有参加反应,B物质反应后质量增加,为生成物,C物质反应后质量减少,为反应物,D物质反应后质量减少,为反应物,,则反应物C和D生成B,故容器中B物质肯定是化合物。
(4)C和D反应后质量减少,为反应物,B物质反应后质量增加,为生成物,A物质反应前后质量没有变化,可能是催化剂或没有参加反应,故容器中发生反应的基本反应类型是化合反应。

 数学奥赛暑假天天练南京大学出版社系列答案
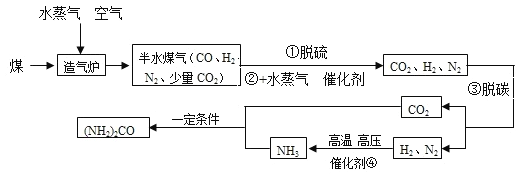
数学奥赛暑假天天练南京大学出版社系列答案【题目】焦炭(主要成分是碳单质,杂质不与水反应) 与水蒸气在高温条件下反应,能产生一种俗称为水煤气的气体燃料,可能还有H2、CO、CO2.某小组同学设计了如下实验装置并进行实验。实验后发现 A 装置中溶液变浑浊,D 中的固体由黑色变红色,E 中的固体由 白色变蓝色,G 装置中有水流入烧杯。(已知无水硫酸铜遇水蒸气变蓝,碱石灰能吸收二氧化碳和水蒸气,浓硫酸能吸收水蒸气)。
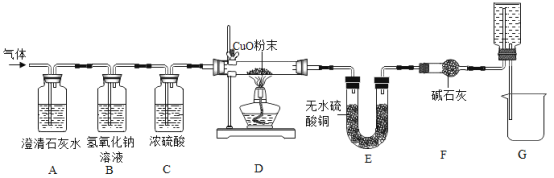
在反应前后对D、E装置进行了质量的测量(各步反应均完全),测量结果如表:
装置及药品 | 反应前 | 反应后 |
D装置中玻璃管与固体的总质量/g | 223.3 | 215.0 |
E装置中U型管与固体的总质量/g | 260.0 | 267.2 |
请分析回答下列问题:
(1)水煤气中一定含有CO2的理由是_____(用化学方程式表示)。
(2)一定能证明水煤气中有氢气存在的实验现象是_____,_____。
(3)G 装置的作用:①“抽气”;②_____。
(4)该小组同学通过数据分析,证明水煤气中存在 CO 气体,请利用上表中的原始数据,列出数据分析过程(只列式不计算)。_____
(5)同学们发现,不通过测量反应前后装置的质量,也可方便的证明 CO 气体的存在。 需增加一个图中的装置_____(填装置序号)来代替装置 F。
【题目】某化学兴趣小组欲通过实验测定某种石灰石中碳酸钙的质量分数。取该石灰石样品8.0g,将80mL稀盐酸分四次加入,所得数据如下表(已知该石灰石中的杂质不溶于水,也不与稀盐酸反应):
实验序号 | 1 | 2 | 3 | 4 |
加入稀盐酸的体积(mL) | 20 | 20 | 20 | 20 |
充分反应后剩余固体的质量(g) | 5.5 | m | 1.2 | n |
(1)上表中,m=_____,n=_____。
(2)该石灰石中碳钙的质量分数为_____。
(3)若要制取6.6g二氧化碳,至少需要该石灰石多少克?_____(写出计算过程,结果精确到0.lg)
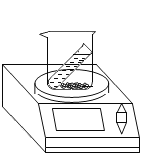
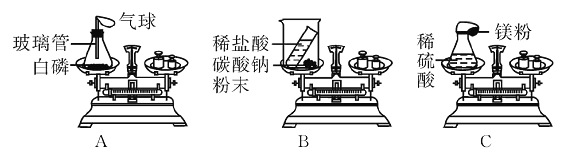
【题目】用如图所示的装置进行实验,验证质量守恒定律。
| 实验1 | 实验2 | ||
实验药品 | 硫酸铜溶液、铁 | 过氧化氢溶液、二氧化锰 | ||
电子秤示数 | 反应前 | m1 | m3 | |
反应后 | m2 | m4 | ||
(1)实验2发生反应的化学方程式为____________________________。
(2)实验2中药品混合后,烧杯内可观察到的现象为___________________。
(3)比较反应前后电子秤示数,描述正确的是__________(填序号)。
Am1=m2 Bm1<m2 Cm3= m4 Dm3> m4