题目内容
【题目】常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。
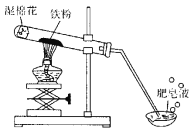
(1)试管尾部放一团湿棉花的目的是______。
(2)探究生成的气体是什么?用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是______。
(3)探究试管中剩余固体成分是什么?
(查阅资料)Fe304不溶于水,能与盐酸反应且没有气体生成。
常见铁的氧化物 | FeO | Fe2O3 | Fe304 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 否 | 否 | 能 |
(初步验证)试管中剩余固体为黑色,能全部被磁铁吸引。
(猜想与假设)猜想一:剩余固体是Fe与Fe3O4;
猜想二:剩余固体是______。
(实验探究)
实验操作 | 实验现象及结论 |
取少量黑色固体于试管中,加入足量的稀盐酸。 | 固体全部溶解,并且没有______产生,说明猜想二成立。 |
(实验结论)铁和水蒸气反应的化学方程式为______。
(反思与交流)该黑色固体不可能是Fe2O3,理由是______。
【答案】提供水蒸气 H2 Fe3O4 气泡 3Fe+4H2O ![]() Fe3O4+4H2 Fe2O3为红棕色
Fe3O4+4H2 Fe2O3为红棕色
【解析】
(1)根据图和“高温下,铁与水蒸气能反应”,可知试管尾部放一团湿棉花的目的是提供水蒸气,故填水蒸气;
(2)用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中.说明生成的气体具有可燃性、密度小于空气,再根据反应物为“铁与水蒸气”,生成的气体是氢气,故填H2;
[猜想与假设]
能被磁铁吸引的只有Fe与Fe3O4,猜想一Fe与Fe3O4,又不可能只有Fe没有其他反应产物,所以猜想二是四氧化三铁,故填Fe3O4;
[实验探究]
根据铁与稀盐酸反应产生气体,进行设计实验:取少量剩余固体于试管中,向其中滴加足量稀盐酸,固体全部溶解,没有产生气泡,说明猜想二正确,故填气泡;
[实验结论]
铁和水蒸气在高温的条件下反应生成四氧化三铁和氢气,化学方程式故填3Fe+4H2O ![]() Fe3O4+4H2;
Fe3O4+4H2;
[反思与交流]
该黑色固体不可能是Fe2O3,理由是Fe2O3红棕色粉末且不能被磁铁吸引,故填Fe2O3为红棕色。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案【题目】某课外兴趣小组的同学设计了如下三个实验来验证质量守恒定律。
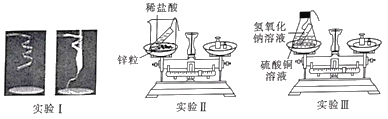
实验I:称量镁条,在空气中点燃,待反应结束后,将生成物全部收回再称量。
实验Ⅱ:将装有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将稀盐酸与锌粒接触,过会儿再称量。
实验Ⅲ:将装有氢氧化钠溶液的试管放入盛有硫酸铜溶液的锥形瓶中,并在锥形瓶口塞上橡皮塞,称量,然后设法将两种溶液接触(有蓝色氢氧化铜沉淀和硫酸钠生成),过一会儿再称量。数据见下表:
编号 | 实验I | 实验Ⅱ | 实验Ⅲ |
反应前的质量/g | 4.8 | 112.6 | 118.4 |
反应后的质量/g | 8.0 | 112.4 | 118.4 |
(1)实验Ⅰ中,发生反应的化学方程式为______,该反应属于基本反应类型中的______反应。
(2)实验Ⅱ中反应后烧杯内的质量比反应前明显减小,原因是______。
(3)这三个实验中,实验Ⅲ正确反映了反应物与生成物之间的质量关系。请从分子、原子的角度解释反应前后质量相等的原因:______。
(4)实验I、Ⅱ不能正确反映反应物和生成物之间的质量关系,选一例说明实验设计中的不当之处并提出改进思路:______。