题目内容
【题目】为减少煤对环境的污染,提高煤的综合利用率。如图是某厂设想利用煤为原料对生产硫酸亚铁的流程进行如下探究,请根据图示,回答下列问题:
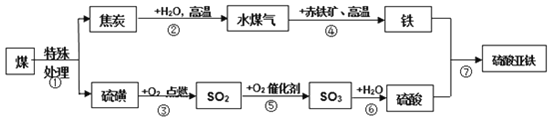
(1)水煤气的主要成分是两种还原性气体,它们分别是______、______(写化学式);
(2)操作步骤②属于______(填“化学”或“物理”)变化;
(3)属于化合反应的有______(填序号);
(4)写出下列反应的化学方程式:④______(只写其中一条);⑦______。
【答案】CO H2 化学 ③⑤⑥ Fe2O3+3H2![]() 3H2O+2Fe或Fe2O3+3CO
3H2O+2Fe或Fe2O3+3CO![]() 3CO2+2Fe Fe+H2SO4=FeSO4+H2
3CO2+2Fe Fe+H2SO4=FeSO4+H2![]()
【解析】
(1)水煤气的主要成分是氢气、一氧化碳,对应的化学式为H2、CO;
(2)操作步骤②是焦炭与水在高温下反应生成一氧化碳和氢气,有新物质产生,是化学变化;
(3)②是焦炭与水在高温下反应生成一氧化碳和氢气,属于置换反应;③是硫在氧气中燃烧生成二氧化硫,为化合反应;④氧化铁和氢气在高温下反应生成铁单质和水,氧化铁和一氧化碳在高温下反应生成二氧化碳和铁,两个反应均属于置换反应;⑤为二氧化硫在氧气和催化作用下反应生成三氧化硫,属于化合反应;⑥为三氧化硫和水反应生成硫酸;⑦铁和硫酸反应生成硫酸亚铁和氢气,属于置换反应;故选③⑤⑥;
(4)反应④为氧化铁和氢气反应生成铁单质和水,氧化铁和一氧化碳反应生成二氧化碳和铁,对应的方程式为Fe2O3+3H2![]() 3H2O+2Fe,Fe2O3+3CO
3H2O+2Fe,Fe2O3+3CO![]() 3CO2+2Fe;反应⑦为铁和硫酸反应生成硫酸亚铁和氢气,对应的方程式为Fe+H2SO4=FeSO4+H2
3CO2+2Fe;反应⑦为铁和硫酸反应生成硫酸亚铁和氢气,对应的方程式为Fe+H2SO4=FeSO4+H2![]() 。
。

【题目】常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。
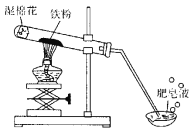
(1)试管尾部放一团湿棉花的目的是______。
(2)探究生成的气体是什么?用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是______。
(3)探究试管中剩余固体成分是什么?
(查阅资料)Fe304不溶于水,能与盐酸反应且没有气体生成。
常见铁的氧化物 | FeO | Fe2O3 | Fe304 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 否 | 否 | 能 |
(初步验证)试管中剩余固体为黑色,能全部被磁铁吸引。
(猜想与假设)猜想一:剩余固体是Fe与Fe3O4;
猜想二:剩余固体是______。
(实验探究)
实验操作 | 实验现象及结论 |
取少量黑色固体于试管中,加入足量的稀盐酸。 | 固体全部溶解,并且没有______产生,说明猜想二成立。 |
(实验结论)铁和水蒸气反应的化学方程式为______。
(反思与交流)该黑色固体不可能是Fe2O3,理由是______。
【题目】我市北临渤海,有保存最完整、且唯一新老堤并存的贝壳堤岛。贝壳的成分是CaCO3(其他成分既不溶于水也不与盐酸反应)。某兴趣小组为了测定该贝壳样品中碳酸钙的质量分数,将一定量的贝壳样品放入烧杯中,再将100g稀盐酸分4次加入烧杯中,每次均充分反应。实验数据记录如表:
次数 | 第一次 | 第二次 | 第三次 | 第四次 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
反应后烧杯中物质的总质量/g | 36.4 | 59.6 | 83.8 | 108.8 |
(1)第1次加入稀盐酸充分反应后,生成二氧化碳的质量是______g。
(2)该贝壳样品中碳酸钙的质量____