题目内容
【题目】地沟油中含有一种强烈致癌物黄曲霉素B2(C17H14O6),长期食用会引起消化道癌变,请回答:
(1)黄曲霉素B2的相对分子质量为 ________________ ;
(2)黄曲霉素B2中碳、氢、氧三种元素的原子个数比为 _______________。
【答案】 314 17:14:6
【解析】(1)根据相对分子质量=相对原子质量与相应原子个数的乘积和,黄曲霉素B2的相对分子质量为:17×12+1×14+16×6=314;
(2)由黄曲霉素B2(C17H14O6)的化学式可知:黄曲霉素B2中碳、氢、氧三种元素的原子个数比为17:14:6。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关
b.可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡。写出锌与盐酸发生反应的化学方程式为_______________________.
从实验现象可判断:金属活动性Zn_______Fe(填“<”、’“=”或“>”).
【得出结论】金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是_______.
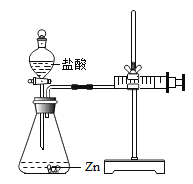
实验(2)为探究猜想b,小组同学设计如上图的装置进行实验,其中注射器的作用是_______.
所用药品、实验数据如下表:
实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
1分钟 | 1﹣2分钟 | 2﹣3分钟 | 3﹣4分钟 | 4﹣5分钟 | 前5分钟共收集气体 | |||
Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【得出结论】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是_________________.
【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸发生反应由慢到快、再由快到慢的原因是_________________________.
【拓展延伸】通过以上探究,你认为金属与盐酸反应的剧烈程度还可能与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响快慢的相关假设因素及实验方案)
【假设】________________________________.
【实验方案】_____________________________.