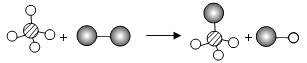
题目内容
【题目】请根据下列装置,回答问题:
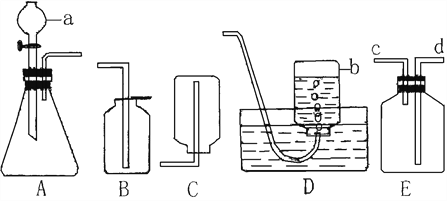
(1)写出标号①②的仪器名称:①______,②______.
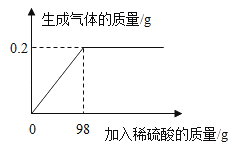
(2)实验室用过氧化氢溶液制取O2,可选用的发生装置是_______(填写装置序号),判断O2已收集满的方法是______.
(3)用高锰酸钾制取O2时,装置A试管口放一小团棉花,该反应的化学方程式是___________.
(4)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应),通过以下四步实验操作可回收二氧化锰.正确操作的先后顺序是______(填写选项序号).
a.烘干 b.溶解
c.过滤 d.洗涤
(5)用装置F制取气体,在反应过程中,用弹簧夹夹住导气管上的橡皮管,过一会儿反应就会停止.其原因是______.
【答案】长颈漏斗集气瓶B将带火星的木条放在瓶口,若木条复燃,说明已收集满2KMnO4△ K2MnO4+MnO2+O2↑bcda反应生成的气体将反应液体压回到长颈漏斗,使液体、固体不再接触,反应停止
【解析】
本题是实验室制取氧气的相关知识,需要从实验室制取氧气的原理、装置、收集、注意事项等方面来考虑。
(1)实验仪器的名称分别是长颈漏斗和集气瓶。
(2)实验室用过氧化氢溶液制取O2,属于固液反应常温型,故应选择B。用向上排空气法收集氧气,判断O2已收集满的方法是:将带火星的木条放在瓶口,若木条复燃,说明已收集满。
(3)2KMnO4△ K2MnO4+MnO2+O2↑。
(4)物质回收应是:溶解、过滤、洗涤、干燥。故应选bcda。
(5)反应停止考虑反应物之间相互不能接触,所以应填:反应生成的气体将反应液体压回到长颈漏斗,使液体、固体不再接触,反应停止。

 阅读快车系列答案
阅读快车系列答案【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关
b.可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡。写出锌与盐酸发生反应的化学方程式为_______________________.
从实验现象可判断:金属活动性Zn_______Fe(填“<”、’“=”或“>”).
【得出结论】金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是_______.
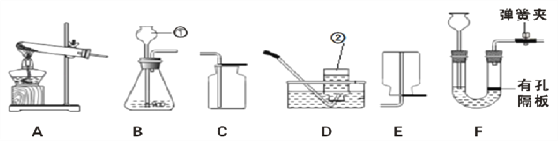
实验(2)为探究猜想b,小组同学设计如上图的装置进行实验,其中注射器的作用是_______.
所用药品、实验数据如下表:
实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
1分钟 | 1﹣2分钟 | 2﹣3分钟 | 3﹣4分钟 | 4﹣5分钟 | 前5分钟共收集气体 | |||
Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【得出结论】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是_________________.
【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸发生反应由慢到快、再由快到慢的原因是_________________________.
【拓展延伸】通过以上探究,你认为金属与盐酸反应的剧烈程度还可能与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响快慢的相关假设因素及实验方案)
【假设】________________________________.
【实验方案】_____________________________.