��Ŀ����
����Ŀ��ij��ȤС�鰴�տα�ʵ�鷽����ͼ����ľ̿������ͭ��Ӧʵ��ʱ�����ֺ��ѹ۲쵽�Ϻ�ɫͭ�����ɣ�ȴ�����а���ɫ������֡����Ǿ��������ʵ�����̽���Ľ���

��������⣩����ɫ�Ĺ�����ʲô�����ѡ����ʵ�������ʹľ̿��ԭ����ͭ��ʵ����������ԣ�
�����ϣ�ͭ��+1��+2���ֻ��ϼۣ�ͨ������£����Ļ��ϼ�Ϊ��2��̼�Ļ��ϼ�Ϊ+4��4��
��1��д��ľ̿��ԭCuO�Ļ�ѧ����ʽ_____��
����������裩
��2��ͬѧ����Ϊ���ְ���ɫ���������һ��ͭ�Ļ�������²����Ļ�ѧʽΪ_____��
��3��ͬѧ�ǻ���Ϊ��ͨ���ı䷴Ӧ���״̬�������ȣ��Լ���Ӧװ�ã�����ʹ��ʵ������������ԣ����ٳ��ְ���ɫ����������
�������뽻����
��С�⽨���ó�ϸ̿��������ͭ��ĩ����ʵ�顣����Ϊ���������ԭ����_____��
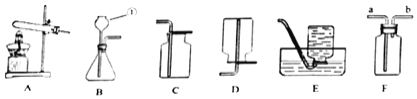
��С�ܽ�����ͼ��װ�������װ�á������Ƚϣ���װ���н��Թ�ֱ�����õ�������_____��
��4����ʵ������ۣ�
ͬѧ�Ǿ������Ľ���ķ�������ʵ�飬�����ڼ�������װ�õ�_____�����Թ��м����Ѹ����ҩƷ����ʼ���ȣ������������ʯ��ˮ���ֻ���ʱ������ȷ������ͭ��̿���Ѿ���ʼ��Ӧ��д������ʯ��ˮ����ǵ�ԭ��_____���û�ѧ����ʽ��ʾ�������ã����ɿ����Թܵײ�����ȣ�ֹͣ���Ⱥ����ܿ��������������Թܵײ����¶������ӣ��������˵���÷�Ӧ��_____���������������������ȷ�Ӧ������Ӧ�������Ƚ������ܴ�ʯ��ˮ��ȡ����Ȼ��ر�ֹˮ�У��ò�����Ȼ��ȴ�������ر�ֹˮ�У����ܳ��ֵ�������_____����������ȴ��ͬѧ�������ҵ����ڴ����õ��Ϻ�ɫͭ�飬ʵ������Բ���ɹ���
���𰸡�2CuO+C![]() 2Cu+CO2�� Cu2O��Cu4C��Cu2C�� ��ϸ̿��������ͭ��ĩ�Ӵ�������� �����ڼ��м��ȣ���ó������� �����ԣ� CO2+Ca��OH��2��CaCO3��+H2O�� �ţ� ��������뷴Ӧ���Թ��У�ʹ���ɵ���Ȼ���ȵ�ͭ���±�����
2Cu+CO2�� Cu2O��Cu4C��Cu2C�� ��ϸ̿��������ͭ��ĩ�Ӵ�������� �����ڼ��м��ȣ���ó������� �����ԣ� CO2+Ca��OH��2��CaCO3��+H2O�� �ţ� ��������뷴Ӧ���Թ��У�ʹ���ɵ���Ȼ���ȵ�ͭ���±�����
��������
��1������ͭ��̼�ڸ����·�Ӧ����ͭ�Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪ2CuO+C![]() 2Cu+CO2����
2Cu+CO2����
��2����Ϊͭ��+1��+2���ֻ��ϼۣ�ͨ������£����Ļ��ϼ�Ϊ��2��̼�Ļ��ϼ�Ϊ+4��4�����ݻ�������Ԫ�صĻ��ϼ۴�����Ϊ���ԭ����ɫ����Ļ�ѧʽ����Ϊ��Cu2O��Cu4C��Cu2C����
��3����С�⽨���ó�ϸ̿��������ͭ��ĩ����ʵ�飬���������ԭ���dz�ϸ̿��������ͭ��ĩ�Ӵ��������
�������Ƚϣ���װ���н��Թ�ֱ�����õ������ǣ������ڼ��м��ȣ���ó������£�
��4��ʵ��ʱ����Ҫ���װ�õ������ԣ�����ʯ��ˮ����ǵ�ԭ���Ƕ�����̼��ʯ��ˮ��Ӧ���ɰ�ɫ̼��Ƴ�����ˮ����Ӧ�Ļ�ѧ����ʽΪ��CO2+Ca��OH��2��CaCO3��+H2O��ֹͣ���Ⱥ����ܿ��������������Թܵײ����¶������ӣ��������˵���÷�ӦҪ�ų���������Ӧ������Ҫ�ر�ֹˮ�У������ر�ֹˮ�У����ܳ��ֵ������ǣ���������뷴Ӧ���Թ��У�ʹ���ɵ���Ȼ���ȵ�ͭ���±�������

����Ŀ����ȤС��ͬѧΪ�˲ⶨij��̼��Ƶ�������������ȡ25.0g�������Ʒ�������Ĵθ������ա���ȴ������ʣ�������ظ����������ʲ��μӷ�Ӧ������¼�������£�
�������� | ��1�� | ��2�� | ��3�� | ��4�� |
ʣ�����������g�� | 21.6 | 19.2 | 16.2 | 16.2 |
�Լ��㣺
��1����ȫ��Ӧ�����ɶ�����̼��������__g��
��2�����������̼��Ƶ�������������д��������̣�__________.