题目内容
【题目】同学们在整理实验室时,发现一包白色粉末状药品,老师说该药品由氯化钠、碳酸钙、氢氧化钠中的两种组成,同学们对此很好奇,于是对这包白色粉末的成分进行如下探究。
(作出猜想)猜想一:_______ 猜想二:CaCO3和NaOH 猜想三:NaCl和NaOH
(设计实验)
实验步骤 | 实验现象 | 实验结论 |
(1)取一定量白色粉末于烧杯中,加足量水,搅拌 | ________ | 猜想三不成立 |
(2)取少量(1)中所得溶液于试管中,向其中滴入氯化铜溶液 | ________ | 猜想二不成立 |
(3)另取少量(1)中所得溶液于试管中,向其中滴加过量的____溶液 | 产生白色沉淀 | 猜想一成立 |
写出步骤(3)中发生反应的化学方程式____。
(拓展延伸)如何测定该白色粉末中碳酸钙的质量分数呢?某同学利用碳酸钙能与稀盐酸反应产生二氧化碳来测定该白色粉末中碳酸钙的质量分数,利用下列装置测定二氧化碳的质量。
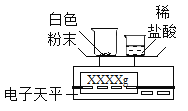
(1)将小烧杯中的所有稀盐酸分几次加入到大烧杯中并不断搅拌,判断白色粉末中碳酸钙完全反应的实验现象是_____。
(2)已知反应前的总质量[m(大烧杯+白色粉末)+m(小烧杯+稀盐酸)],要计算生成CO2的质量,至少还需要的数据是____(填序号)。
A m(小烧杯) B m(大烧杯) C m(大烧杯+反应后剩余物)
【答案】NaCl和CaCO3 固体部分溶解 无明显现象 硝酸银 NaCl+AgNO3=NaNO3+AgCl↓ 加入稀盐酸后没有气泡产生 AC
【解析】
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,碳酸钙不溶于水,氢氧化钠和氯化铜反应生成氢氧化铜和氯化钠,氯化钠和硝酸银反应生成氯化银和硝酸钠。
[作出猜想]
药品由氯化钠、碳酸钙、氢氧化钠中的两种组成,猜想二是CaCO3和NaOH和猜想三是NaCl和NaOH,猜想要全面,形成对照,故猜想一:NaCl和CaCO3。
[设计实验]
碳酸钙不溶于水,氢氧化钠和氯化铜反应生成氢氧化铜和氯化钠,氯化钠和硝酸银反应生成氯化银和硝酸钠。
实验步骤 | 实验现象 | 实验结论 |
(1)取一定量白色粉末于烧杯中,加足量水,搅拌 | 固体部分溶解 | 猜想三不成立 |
(2)取少量(1)中所得溶液于试管中,向其中滴入氯化铜溶液 | 无明显现象 | 猜想二不成立 |
(3)另取少量(1)中所得溶液于试管中,向其中滴加过量的硝酸银溶液 | 产生白色沉淀 | 猜想一成立 |
步骤(3)中发生反应是氯化钠和硝酸银反应生成氯化银和硝酸钠,反应的化学方程式为NaCl+AgNO3=NaNO3+AgCl↓。
[拓展延伸]
(1)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,故判断白色粉末中碳酸钙完全反应的实验现象是加入稀盐酸后没有气泡产生。
(2)由质量守恒定律可知,反应前后物质质量差就是生成二氧化碳的质量,已知反应前的总质量[m(大烧杯+石灰石粉末)+m(小烧杯+稀盐酸)],要计算生成CO2的质量,至少还需要的数据是m(小烧杯)和m(大烧杯+反应后剩余物),则二氧化碳的质量=[m(大烧杯+石灰石粉末)+m(小烧杯+稀盐酸)]-[ m(小烧杯) +m(大烧杯+反应后剩余物)],故选AC。

 阅读快车系列答案
阅读快车系列答案【题目】为测定某CuSO4溶液中溶质的质量分数,取150g CuSO4溶液,平均分为三份,每份样品均按如图所示进行实验,实验数据见下表。请计算:
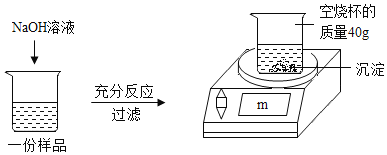
实验1 | 实验2 | 实验3 | |
样品质量/g | 50 | 50 | 50 |
NaOH溶液质量/g | 20 | 40 | 60 |
m/g | 42.45 | 44.9 | 44.9 |
(1)50g CuSO4溶液完全反应时,所得沉淀的质星为_____g。
(2)CuSO4溶液中溶质的质量分数为_____。