题目内容
【题目】人类社会发展离不开金属材料。
(1)图1是某硬铝的主要成分。将适量硬铝(已用砂纸打磨处理)放入足量稀硫酸中,反应的化学方程式有________________。
(2)将足量硬铝粉末放入硝酸银溶液中,充分反应后,溶液出现蓝色,出现蓝色的原因是________________,写出此时溶液中所含的阳离子:________________。
(3)相同条件下,取相同状态的金属钪(Se)和铝分别与相同浓度的盐酸反应,钪产生气泡速率明显更快,则金属活动性Se________________Al(填“>”或“<”)。根据上述结论,下列说法中不正确的是___________(填字母序号)。
A 将Se投入CuSO4溶液中有红色物质析出
B 仅用Fe(NO3)2溶液、Se( NO3)3溶液、Ag能验证钪和铁的活动性强弱
C 仅用Fe、Se、稀H2SO4溶液能验证钪和铁的活动性强弱
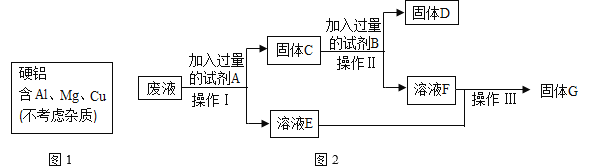
(4)想从含有氯化亚铁、氯化铜的废液中回收金属铜和氯化亚铁晶体.设计了图2所示实验方案。
①操作I的名称是____。
②操作II中加入过量的试剂B的目的是_______________________。
③操作Ⅲ除去的物质是______________________(填化学式)。
【答案】![]() 、
、 ![]() 溶液中有Cu 2+产生[或Cu和AgNO3反应生成了Cu(NO3)2,Cu(NO3)2溶液呈蓝色 ] Cu 2+ 、Al 3+、Mg 2+ > B 过滤 除去多余的铁粉 H2O
溶液中有Cu 2+产生[或Cu和AgNO3反应生成了Cu(NO3)2,Cu(NO3)2溶液呈蓝色 ] Cu 2+ 、Al 3+、Mg 2+ > B 过滤 除去多余的铁粉 H2O
【解析】
(1)硬铝的主要成分铝、镁和铜。将适量硬铝放入足量稀硫酸中,铝和镁能与硫酸反应,反应的化学方程式分别是![]() 、
、![]() 。
。
(2)将足量硬铝粉末放入硝酸银溶液中,充分反应后,溶液出现蓝色,说明铜与硝酸银溶液反应,生成硝酸铜和银,所以出现蓝色的原因是溶液中有Cu 2+产生。铜都参与了反应,则硬铝中的铝和镁也肯定参与了反应,且已经反应完,所以反应后溶液中的溶质有硝酸铝、硝酸镁和硝酸铜,因为硬铝粉是足量,所以硝酸银溶液全部被反应完,故此时溶液中所含的阳离子有:Cu 2+ 、Al 3+、Mg 2+。
(3)相同条件下,取相同状态的金属钪(Se)和铝分别与相同浓度的盐酸反应,钪产生气泡速率明显更快,则金属活动性Se>Al。根据上述结论,选择不正确的说法。
A、因为钪的活动性强于铝,铝的活动性强于铜,则钪的活动性也强于铜。故将Se投入CuSO4溶液中有红色物质析出,A正确;
B、根据这三种金属的活动性,银与Fe(NO3)2溶液或Se( NO3)3溶液不反应,无明显现象产生,故仅用Fe(NO3)2溶液、Se( NO3)3溶液、Ag无法验证钪和铁的活动性强弱,B不正确;
C、已知金属活动性Se>Al,Al > Fe,把Fe和Se分别放入相同的稀H2SO4溶液中,钪产生气泡速率明显更快,故能验证钪和铁的活动性强弱,C正确。故选B。
(4)①加试剂A,通过操作I可以使混合物中固体和液体分离,则操作I是过滤。
②加入的试剂A应该是铁粉,则固体C中含有铜和铁,在操作II中加入过量的试剂B,试剂B为稀盐酸,目的是除去多余的铁粉。
③通过操作Ⅲ可以从氯化亚铁溶液中得到氯化亚铁晶体,故除去的物质是H2O 。

【题目】下列实验方案不能达到实验目的是( )
序号 | A | B | C | D |
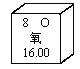
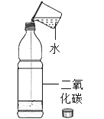
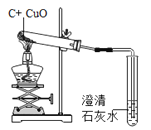
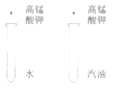
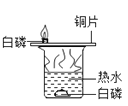
目的 | 证明二氧化碳溶于水且能和水反应 | 证明碳与氧化铜能发生反应 | 探究同种溶质在不同的溶剂的溶解性 | 探究燃烧的条件是燃烧需要氧气 |
方案 |
|
|
|
|
A. AB. BC. CD. D