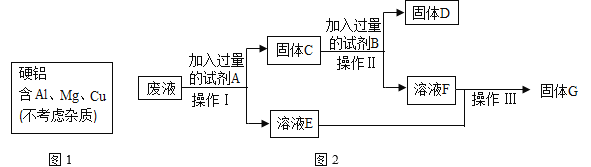
题目内容
【题目】将7g废铁屑放入盛有100g7.3%稀盐酸的烧杯中,恰好完全反应(假设杂质不参加反应)。此时测得烧杯内各物质的总质量为106.8g。计算:(有关反应的化学方程式为:Fe+2HCl=FeCl2+H2↑)
(1)稀释_____g20%的盐酸溶液可得100g7.3%的稀盐酸。
(2)反应产生氢气的质量为_____g。
(3)废铁屑中铁的质量分数。
【答案】(1)36.5;(2)0.2;(3)80%
【解析】
解:(1)溶液稀释过程中溶质的质量保持不变
设需要20%的盐酸的质量为x
20%x=100g×7.3%
x=36.5g
(2)根据质量守恒定律可得,生成的氢气的质量为7g+100g﹣106.8g=0.2g
(3)设样品中铁的质量为y
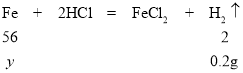
![]()
y=5.6g
则废铁中铁的质量分数为![]() ×100%=80%
×100%=80%

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
【题目】下列图象中有关的量的变化与对应叙述相符的是( )
A | B | C | D |
|
|
|
|
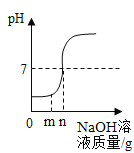
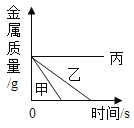
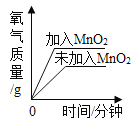
向盐酸中加入的氢氧化钠溶液为mg时,所得溶液显碱性 | 向三份完全相同的稀盐酸中分别加入甲、乙、丙三种金属,则甲、乙的金属活动性比丙的强 | 用等质量、等浓度的双氧水分别制取氧气 | 将a、b、c三种物质的饱和溶液分别由t1℃升温至t2℃时,所得溶液变成不饱和溶液 |
A.AB.BC.CD.D