题目内容
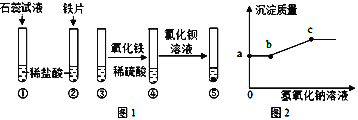
【题目】粗盐中常含有氯化钙,氯化镁,碳酸钠等杂质。得到氯化钠晶体的流程如下。
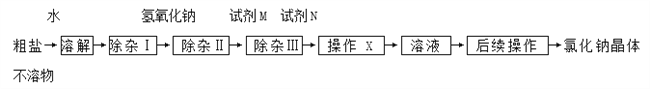
﹙1﹚为了使杂质能够完全被除去,对所加入试剂的量的要求是_________;
﹙2﹚操作X是___________;
﹙3﹚加入试剂N可以除去的杂质是____________;
﹙4﹚后续操作是______________________。
【答案】 过量 过滤 CaCl2 BaCl2 加入过量(或适量稀盐酸),蒸发
【解析】①要使杂质能够完全被除去,加入试剂应稍过量;②操作X是将不溶物分离出来,可知是选用过滤的方法;③除去粗盐中的氯化钙,氯化镁和硫酸钠,除钙离子用碳酸钠,除去镁离子用氢氧化钠,除去硫酸根用氯化钡,观察流程图可知先加入稍过量的氢氧化钠除去氯化镁,此时溶液中含有氯化钙、硫酸钠、氢氧化钠杂质,然后加入稍过量的氯化钡试剂M除掉硫酸钠,溶液中含有氯化钡、氯化钙杂质,加入试剂N碳酸钠除去氯化钡、氯化钙,过滤,所得溶液含有碳酸钠杂质,﹙4﹚后续操作是可加入过量的稀盐酸并加热蒸发得到氯化钠晶体。

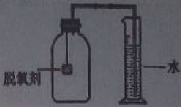
【题目】(7分)食品包装袋中常用脱氧剂。某化学兴趣小组将脱氧剂封口打开,将其倒在滤纸上,
观察到脱氧剂大部分为黑色粉末,其中还夹杂着少量红色粉末。
【提出问题】该脱氧剂中的黑色、红色粉末各是什么?
【提出猜想】黑色粉末可能含炭粉、铁粉、氧化铜中的一种或几种。红色粉末可能含有氧
化铁、铜粉中的一种或几种。
【进行实验】
实验编号 | 实验操作 | 实验现象 |
① | 取脱氧剂粉末加入足量稀硫酸 | 粉末几乎全部溶解,只有少量黑色粉末未溶解,有气泡产生,溶液变成黄色 |
② | 去实验①的残渣灼烧,将内壁有澄清石灰水的小烧杯罩在上方 | 澄清石灰水变浑浊 |
【得出结论】由实验①②可知,脱氧剂中黑色粉末肯定含 。
脱氧剂中的红色粉末肯定不含 ,肯定含 ,写出相应的化学方程式 。
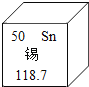
【拓展延伸】小明认为铁生锈时会消耗氧气,因此可用此脱氧剂(实验室可滴几滴水)测定空气中氧气的含量,装置如图所示。集气瓶的实际容积是150mL,量筒内盛100mL的水。当量筒内水面不再变化,且温度恢复至室温时,读出水面在73mL刻度处。由上述实验数据可以算出,空气中氧气的体积分数是 。本实验的测量结果与理论值不一致,原因可是 。