题目内容
【题目】海水中镁的总储量约为2.1×1015 t,可用于生产金属镁,目前全世界生产的镁60%来 自海水。利用海水提取镁的工业流程如下图所示。
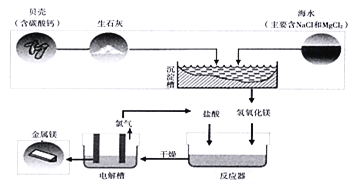
(1)海水属于____(填“混合物”或“纯净物”)。
(2)电解槽中发生的反应为: ![]()
若要制得24 kg金属镁,至少需要MgCl2的质量为____kg。
(3)请写出反应器中发生中和反应的化学方程式:____________________。
(4)氯气可以发生化合反应生成氯化氢,其水溶液为盐酸。推测另一种反应物为____。
【答案】 混合物 95 2HCl + Mg(OH)2=MgCl2 + 2H2O H2
【解析】(1)海水中含有水、氯化钠、氯化镁等物质,属于混合物。
(2)设若要制得24kg金属镁,至少需要MgCl2的质量为x。
MgCl2 ![]() Mg + Cl2
Mg + Cl2![]()
95 24
x 24kg
![]() =
=![]() ,解得x=95kg
,解得x=95kg
(3)酸碱之间的反应是中和反应,盐酸属于酸,氢氧化镁属于碱,酸碱反应生成盐和水。
(4)化学反应前后元素的种类不变。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目