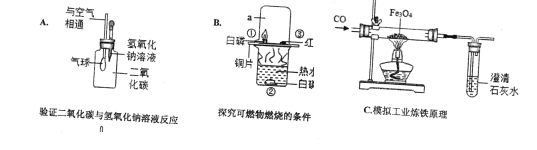
题目内容
【题目】现有100g 8%的NaOH溶液,请按下面要求计算:
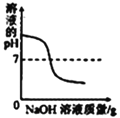
(1)该溶液的pH_______7(选填“>”“=”或“<”)。
(2)若用该溶液吸收CO2,最多可以生成Na2CO3________?(写出详细计算过程)
(3)当NaOH全部转化成后,Na2CO3还会继续与CO2、H2O发生反应:Na2CO3+CO2+H2O =2NaHCO3,直至Na2CO3完全反应完。请在下图画出利用100g 8%的NaOH溶液吸收CO2直至生成NaHCO3的曲线。
 ________________
________________
【答案】 > 10.6g 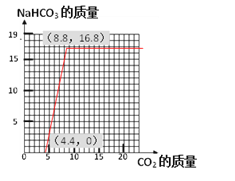
【解析】本题考查了根据化学方程式的计算并根据所得数据绘制曲线。
(1)氢氧化钠溶液呈碱性,其pH<7;
(2)100g溶液中所含溶质的质量=100g×8%=8g;
设: 可以生成Na2CO3质量为x,消耗的二氧化碳的质量为
2NaOH +CO2═Na2CO3+H2O
80 44 106
8g y x
![]() x=10.6g
x=10.6g
![]() y=4.4g
y=4.4g
(3)设:与10.6g碳酸钠反应需要二氧化碳的质量为a,同时生成碳酸氢钠的质量为b
Na2CO3+CO2+H2O =2NaHCO3
106 44 168
10.6g a b
![]() a=4.4g
a=4.4g
![]() b=16.8g
b=16.8g
100g 8%的NaOH溶液吸收CO2直至生成NaHCO3的曲线分两段,一段是NaOH溶液与4.4g的CO2反应生成碳酸钠,碳酸钠溶液与4.4g的二氧化碳反应生成16.8g的NaHCO3,反应结束后NaHCO3的质量不再增加。曲线如图: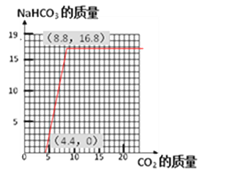

【题目】小明选择“铝丝和盐酸反应的快慢与什么因素有关”的课题开展探究。下表是他分别用相同质量的铝丝和足量稀盐酸反应的三组实验数据:
实验编号 | 盐酸的浓度/% | 反应温度/℃ | 铝丝消失 的时间/s |
① | 3 | 20 | 500 |
② | 6 | 20 | 300 |
③ | 6 | 30 | 80 |
(1)写出铝和盐酸反应的化学方程式:________________________________。
(2)实验②和③表明:该反应的快慢与__________有关。
(3)能表明盐酸浓度对反应快慢有影响的实验编号是________和________。
(4)如果把实验①中盐酸的浓度改为4%,请你推出铝丝消失的时间(用t表示)的取值范围:________________。
(5)该实验除了用铝丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?
方法:_____________________________________________________________________。
【题目】下列4个坐标图分别表示4个实验过程中某些质量的变化,其中正确的是( )
A | B | C | D |
加水稀释氢氧化钠溶液 | 一定量的稀硫酸与镁条反应,溶液的质量与反应时间的关系 | 向两份完全相同的稀盐酸中分别加入足量铁粉、镁粉 | 等体积、等质量分数的过氧化氢溶液制取氧气 |
|
|
|
|
A. A B. B C. C D. D