题目内容
【题目】下列四种叙述均用所对应的图象表示,其中图象错误的是( )
A.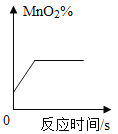 表示加热氯酸钾固体与MnO2反应过程中,MnO2的质量分数变化关系
表示加热氯酸钾固体与MnO2反应过程中,MnO2的质量分数变化关系
B.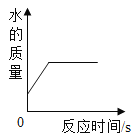 表示往过氧化氢溶液加入少量的MnO2反应过程中,溶液中水的质量变化关系.
表示往过氧化氢溶液加入少量的MnO2反应过程中,溶液中水的质量变化关系.
C.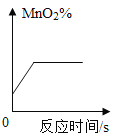 表示一定量KMnO4加热制O2过程中,残留固体中MnO2的质量分数与时间的关系
表示一定量KMnO4加热制O2过程中,残留固体中MnO2的质量分数与时间的关系
D.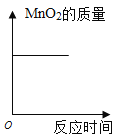 表示加热氯酸钾固体与MnO2的过程中,MnO2的质量变化关系
表示加热氯酸钾固体与MnO2的过程中,MnO2的质量变化关系
【答案】C
【解析】
A、MnO2在氯酸钾加热制O2过程中是一种催化剂。因此在化学反应前后,二氧化锰的质量不变。在还未反应时,二氧化锰就在容器中,所以此时质量分数不为零。但是在该反应中,生成物之一是氧气,是一种气体,所以物质的总质量逐渐减小。所以二氧化锰的质量分数逐渐增大。故A正确;
B、往过氧化氢溶液加入少量的MnO2,过氧化氢分解生成水并放出氧气。初始状态下,过氧化氢溶液中就包括水,所以图像的起点不为0。过氧化氢溶液中随着过氧化氢不断分解,溶液中水的质量则不断增加,直到过氧化氢完全分解,水的质量不再改变。故B正确;
C、MnO2在KMnO4加热制O2过程中是一种生成物,因此在反应没有开始时,固体中并没有MnO2。所以图像的起点应为0。随着反应的进行,二氧化锰的质量增加,而且生成物有气体逸出,二氧化锰的质量分数逐渐增加。当反应停止,二氧化锰的质量不变。故C错误;
D、二氧化锰在加热氯酸钾制氧气的过程中是一种催化剂。催化剂在化学反应前后质量不变。所以图像应改为一条不为0的横线。故D正确。
故选C。

 寒假创新型自主学习第三学期寒假衔接系列答案
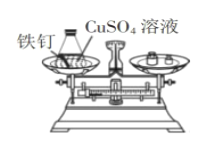
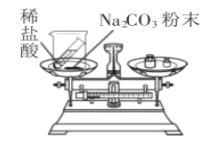
寒假创新型自主学习第三学期寒假衔接系列答案【题目】“质量守恒定律”是我们学习化学的一个重要定律。某兴趣小组同学想通过实验验证质量守恒定律,请你参与他们的探究吧。
[查阅资料]①![]() ②
②![]()
[提出问题]设计实验验证质量守恒定律。
[进行实验]
实验一 | 实验二 | |
实验方案. |
|
|
实验现象 | _____。 | 有气泡冒出,天平指针向右偏转。 |
实验结论 | 反应前后质量相等。 反应的化学方程式为_____。 | 反应前后质量不相等。 |
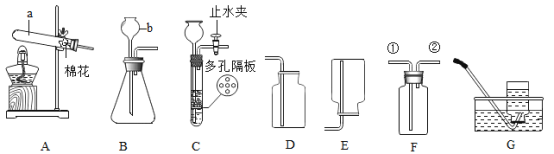
[反思评价]通过讨论,同学们发现实验二中有气体逸出,导致指针右偏转。得到启示:在探究化学反应前后各物质质量总和是否相等时,凡有气体生成或参加的反应,一定要在_____中进行。
[改进装置]如图是同学们对实验二中的装置进行的如下改进,你认为最佳装置是_____(填序号),说一说另一装置的不足之处:_____。

[解释应用](1)化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
(2)铜丝在火焰上灼烧,灼烧后的“铜丝”的质量_____(填“大于”或“小于”)原来铜丝的质量,原因是_____。