题目内容
【题目】 金属锰可以增强合金材料的硬度、耐磨性等。工业上通常用菱锰矿(主要成分为MnCO3)冶炼金属锰。其工艺流程如下:
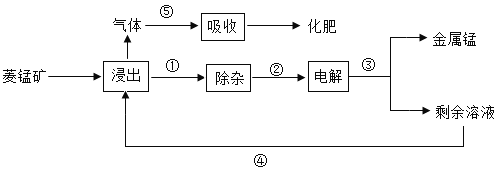
(1)浸出是将菱锰矿与稀硫酸混合制得硫酸锰(MnSO4),反应的化学方程式是_____。
(2)除去浸出液中的Fe2+,获得金属锰。这个过程中发生的主要反应有(其中NH3·H2O中各元素的化合价与NH3、H2O中各元素化合价相等):
I.2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3 +2H2O
II.Fe2(SO4)3 +6NH3·H2O=2Fe(OH)3↓+3(NH4)2SO4
III.2MnSO4+2H2O![]() 2Mn+2H2SO4+O2↑
2Mn+2H2SO4+O2↑
上述三个反应中,反应前后有化合价变化的元素有_____。
(3)浸出过程中产生的气体可以用氨水吸收得到化肥碳酸氢铵,碳酸氢铵属于_____肥。
(4)现代化工生产必须考虑节能减排,在上述生产①~⑤过程中,符合“减排”做法的是____。
【答案】MnCO3+H2SO4=MnSO4+H2O+CO2↑ Mn、Fe、O 氮 ④⑤
【解析】
(1)将菱锰矿(主要成分为MnCO3)与稀硫酸混合制得硫酸锰(MnSO4),是碳酸锰与硫酸反应生成硫酸锰、二氧化碳和水,反应的化学方程式是MnCO3+H2SO4=MnSO4+H2O+CO2↑。
(2)I.2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3 +2H2O,该反应中铁元素的化合价由反应前的+2价变为反应后的+3价;II.Fe2(SO4)3 +6NH3·H2O=2Fe(OH)3↓+3(NH4)2SO4,该反应中各元素化合价反应前后都不变;III.2MnSO4+2H2O![]() 2Mn+2H2SO4+O2↑,该反应中锰元素由反应前的+2价变为反应后的0价,氧元素的化合价由反应前的-2价变为反应后的0价。所以上述三个反应中,反应前后元素化合价发生变化的元素有:铁元素、锰元素和氧元素。故填:Mn、Fe、O。
2Mn+2H2SO4+O2↑,该反应中锰元素由反应前的+2价变为反应后的0价,氧元素的化合价由反应前的-2价变为反应后的0价。所以上述三个反应中,反应前后元素化合价发生变化的元素有:铁元素、锰元素和氧元素。故填:Mn、Fe、O。
(3)碳酸氢铵含有氮元素,属于氮肥。故填:氮。
(4)现代化工生产必须考虑节能减排,在上述生产①~⑤过程中,④是回收硫酸防止水污染且节约资源;⑤是防止大气污染综合利用成化肥,因此符合“减排”做法的是④⑤。故填:④⑤。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案