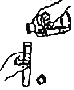题目内容
【题目】某化学课堂上同学们正在进行酸、碱、盐知识的探究,以下是教学片断,请你参与其中并认真填写空格.
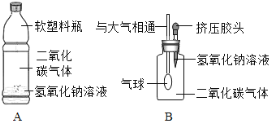
(学生实验)将二氧化碳分别通入澄清石灰水和氢氧化钠溶液中,观察到前者变浑浊,后者无明显现象.
(提出问题)二氧化碳通入氢氧化钠溶液中无明显现象,两者是否发生了化学反应?
(猜想假设)猜想①:两者发生了化学反应;猜想②:两者没有发生化学反应。
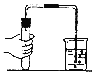
(实验探究)(1)小华设计了如图所示的A、B两个实验,实验现象:A中_______________,B中_______________。
(2)小红认为小华的实验是可行的,其共同原理是二氧化碳和氢氧化钠溶液反应,使容器内压强降低,小明同学却对此提出质疑,他认为小华的实验不严谨,其理由是________________ .要得到科学严谨的结论,如果利用B装置,应补充做的实验是____________,如果观察到_______________,则证明猜想①成立。
(3)小宁设计的是通过检验生成物来验证猜想,请你帮她填写实验报告.
实验步骤 | 实验现象 | 实验结论 |
向B实验后的溶液加入_________. | _________________ | 猜想①成立,相关化学方程式________________. |
(反思拓展)(1)氢氧化钠溶液必须密封保存,原因是(方程式)__________________。
(2)通过同学们的探究,我们发现,对于没有明显现象的化学反应,可以从两个不同的角度证明:______________________ ; ______________________。
【答案】塑料瓶变瘪 气球膨胀 二氧化碳能与水反应或溶于水,也能使容器内气体减少,压强变小 将氢氧化钠溶液换成等体积的水,再与实验B作对比 气球膨胀的程度不相同 稀盐酸 有气泡产生 Na2CO3+2HCl =2NaCl+H2O+CO2↑ 2NaOH +CO2=Na2CO3+H2O 检验反应物减少证明反应发生 也可以检验生成物存在证明反应发生
【解析】
[实验探究](1)小华设计了如图所示的A、B两个实验,实验现象:A中由于气体减少,压强变小,故塑料瓶变瘪,B中由于气体减少,压强变小,在大气压的作用下,气球膨胀。
(2)小明同学认为小华的实验不严谨,其理由是二氧化碳能与水反应或溶于水,也能使容器内气体减少,压强变小。要得到科学严谨的结论,如果利用B装置,应补充做的实验是将氢氧化钠溶液换成等体积的水,再与实验B作对比,如果观察到气球膨胀的程度不相同,则证明猜想①成立。
(3)二氧化碳与氢氧化钠溶液反应生成碳酸钠、水,碳酸钠溶液能与稀盐酸反应生成二氧化碳气体,当观察到有气泡产生时,说明猜想①成立,相关化学方程式为:Na2CO3+2HCl =2NaCl+H2O+CO2↑
[反思拓展](1)氢氧化钠溶液必须密封保存,原因是氢氧化钠能与二氧化碳反应:2NaOH +CO2=Na2CO3+H2O。
(2)对于没有明显现象的化学反应,可以从两个不同的角度证明:检验反应物减少证明反应发生,也可以检验生成物存在证明反应发生。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学兴趣小组同学对课本上铁丝燃烧实验产生了兴趣,他们进行了如下探究:
(提出问题)铁丝在空气中不能燃烧的原因是什么?
(猜想与假设)
猜想1:氧气浓度的原因;猜想2:铁丝种类的原因。
(实验探究)
实验编号 | 氧气浓度 | 铁丝种类 | 燃烧现象 |
1 | 60% | 直径0.38mm铁丝 | 燃烧,火星四射 |
2 | 21% | 直径0.38mm铁丝 | 不能燃烧 |
3 | 21% | 铁丝绒 | 持续燃烧,红热火星较快向四周扩散 |
(1)做铁丝燃烧实验时必须用砂纸打磨,原因是_______________________________________.
(2)铁丝燃烧的文字表达式是__________________________________________.
(3)由实验1和实验________ 可知猜想1正确;由实验2和实验________ 可知猜想2正确。
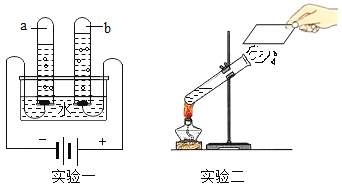
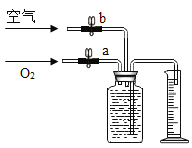
(4)若用如图装置收集一瓶(150mL)含氧气的体积分数约为60%的空气气体,方法是在150mL集气瓶里装满水,塞紧胶塞并关闭活塞b,打开活塞a通入氧气,把集气瓶里的水排入量筒,当量筒内的水达到设定的体积后立即关闭活塞a,然后打开活塞b通入空气,把集气瓶里的水全部排入量筒。则停止通入氧气时量筒内水的体积约为________ (提示:空气中氧气的体积分数约为20%)。
【题目】某课外小组研究“影响H2O2 生成O2快慢的因素”的课题。通过查阅资料,他们提出如下猜想。
(提出猜想)催化剂和反应物浓度都会影响H2O2 生成O2 的快慢
(实验过程)实验装置图如下:
实验操作:检查装置气密性良好。将分液漏斗中的液体加入锥形瓶中,立即收集一瓶放出的气体。实验记录
实验编号 | ① | ② | ③ |
反应物 | 5%H2O2 100 mL | 5%H2O2 | 3%H2O2 100 mL |
加入固体 | 0.5 g氯化钠固体 | 0.5 g二氧化锰 | |
收集气体的时间 | 165 s | 46 s | 80 s |
(1)实验②中加入H2O2的体积为_________mL。
(2)实验③中加入的固体和用量为___________。
(结论)该探究过程得出的结论是 ___________。
(反思)H2O2在常温下分解缓慢,加入MnO2 后反应明显加快。小红提出,为了更好的证明二氧化锰和氯化钠是否对H2O2 生成O2快慢有影响,还应该增加一组对比实验。该实验选用的药品和用量为______。
(实验拓展)小红用排水法收集的气体进行氧气的性质实验。
(1)小红进行硫磺和氧气的反应的性质实验时,在空气中与在氧气中对比燃烧,现象差别不明显。造成这种结果的原因是_________________。
(2)为探究影响过氧化氢分解速度的因素,小雨阅读课外资料得知:过氧化氢分解除了用二氧化锰,还可用氧化铜等物质作催化剂。于是在室温下做了如下实验,实验数据记录如下:
过氧化氢的质量 | 过氧化氢的浓度 | CuO的质量 | 相同时间内产生O2体积 | |
Ⅰ | 100.0g | 1% | 0.0g | 5 mL |
Ⅱ | 100.0g | 1% | 2g | 32 mL |
Ⅲ | 100.0g | 4% | 2g | 64 mL |
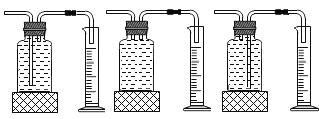
①本实验中,测量O2体积的装置是________(填编号)。
②通过对上表数据分析,I和II对比影响过氧化氢分解速率的因素是__________;III和II对比影响过氧化氢分解速率的因素是______
③写出该反应的文字表达式__________
④小雨进认为只根据加入CuO在反应中的现象还不能确定其为催化剂,还需验证__
⑤小雨利用上述原理制氧气,若达到可随时控制生成气体的速度的目的,应选择的发生装置________填序号)。
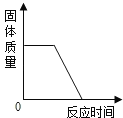
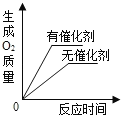
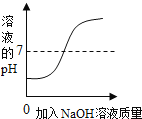
【题目】下列四个图象能正确反映其对应实验操作的是( )
|
|
|
|
A.高温煅烧一定质量的石灰石 | B.用等质量、等浓度的双氧水分别制取氧气 | C.向一定体积的稀盐酸中逐滴加入氢氧化钠溶液 | D.某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体 |
A. AB. BC. CD. D