题目内容
【题目】某课外小组研究“影响H2O2 生成O2快慢的因素”的课题。通过查阅资料,他们提出如下猜想。
(提出猜想)催化剂和反应物浓度都会影响H2O2 生成O2 的快慢
(实验过程)实验装置图如下:
实验操作:检查装置气密性良好。将分液漏斗中的液体加入锥形瓶中,立即收集一瓶放出的气体。实验记录
实验编号 | ① | ② | ③ |
反应物 | 5%H2O2 100 mL | 5%H2O2 | 3%H2O2 100 mL |
加入固体 | 0.5 g氯化钠固体 | 0.5 g二氧化锰 | |
收集气体的时间 | 165 s | 46 s | 80 s |
(1)实验②中加入H2O2的体积为_________mL。
(2)实验③中加入的固体和用量为___________。
(结论)该探究过程得出的结论是 ___________。
(反思)H2O2在常温下分解缓慢,加入MnO2 后反应明显加快。小红提出,为了更好的证明二氧化锰和氯化钠是否对H2O2 生成O2快慢有影响,还应该增加一组对比实验。该实验选用的药品和用量为______。
(实验拓展)小红用排水法收集的气体进行氧气的性质实验。
(1)小红进行硫磺和氧气的反应的性质实验时,在空气中与在氧气中对比燃烧,现象差别不明显。造成这种结果的原因是_________________。
(2)为探究影响过氧化氢分解速度的因素,小雨阅读课外资料得知:过氧化氢分解除了用二氧化锰,还可用氧化铜等物质作催化剂。于是在室温下做了如下实验,实验数据记录如下:
过氧化氢的质量 | 过氧化氢的浓度 | CuO的质量 | 相同时间内产生O2体积 | |
Ⅰ | 100.0g | 1% | 0.0g | 5 mL |
Ⅱ | 100.0g | 1% | 2g | 32 mL |
Ⅲ | 100.0g | 4% | 2g | 64 mL |
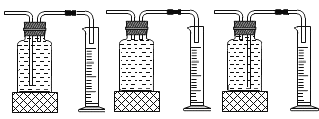
①本实验中,测量O2体积的装置是________(填编号)。
②通过对上表数据分析,I和II对比影响过氧化氢分解速率的因素是__________;III和II对比影响过氧化氢分解速率的因素是______
③写出该反应的文字表达式__________
④小雨进认为只根据加入CuO在反应中的现象还不能确定其为催化剂,还需验证__
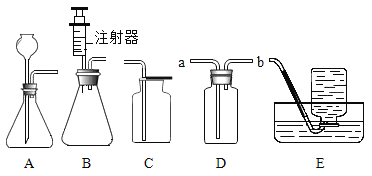
⑤小雨利用上述原理制氧气,若达到可随时控制生成气体的速度的目的,应选择的发生装置________填序号)。
【答案】100mL 0.5g二氧化锰 加入催化剂,提高药品浓度会加快化学反应速度 5%H2O2、100mL 没有等到气泡连续冒出时就开始收集,气体不纯 c 催化剂 药品浓度 过氧化氢![]() 水+氧气 质量和化学性质不变 B
水+氧气 质量和化学性质不变 B
【解析】
[实验过程] (1)做对比实验,必须要变量唯一性,故实验②中加入H2O2的体积为100mL。
(2)实验③的目的是通过与实验②的对比,探究反应物浓度是否会影响H2O2生成O2 的快慢,故实验③中加入的固体是二氧化锰,用量为0.5g。
[结论]该探究过程得出的结论是加入催化剂、提高药品浓度会加快化学反应速度。
[反思]H2O2在常温下分解缓慢,加入MnO2 后反应明显加快。小红提出,为了更好的证明二氧化锰和氯化钠是否对H2O2 生成O2快慢有影响,还应该增加一组对比实验。该实验选用的药品是5%H2O2溶液、用量为100mL。
[实验拓展] (1)小红进行硫磺和氧气的反应的性质实验时,在空气中与在氧气中对比燃烧,现象差别不明显。造成这种结果的原因是没有等到气泡连续冒出时就开始收集,导致收集的氧气不纯。
(2)①本实验中,测量O2体积的装置必须是水由长导气管排出,故选c。②通过对上表数据分析,I中没有加催化剂,II中加入了催化剂,其它条件相同,通过I和II对比可知,影响过氧化氢分解速率的因素是催化剂;III和II对比影响过氧化氢分解速率的因素是药品浓度。③过氧化氢分解制取氧气的文字表达式为:过氧化氢![]() 水+氧气。④催化剂在化学反应前后质量和化学性质不变,所以只根据加入CuO在反应中的现象还不能确定其为催化剂,还需验证CuO的质量和化学性质不变。⑤B装置中用到了注射器,可通过控制推注射器的快慢来控制过氧化氢溶液的滴加速度,从而控制生成气体的速度。
水+氧气。④催化剂在化学反应前后质量和化学性质不变,所以只根据加入CuO在反应中的现象还不能确定其为催化剂,还需验证CuO的质量和化学性质不变。⑤B装置中用到了注射器,可通过控制推注射器的快慢来控制过氧化氢溶液的滴加速度,从而控制生成气体的速度。

 阅读快车系列答案
阅读快车系列答案【题目】某兴趣小组在制取氧气的实验过程中,有如下实验设计方案,该方案的实验目的是:探究氯酸钾和二氧化锰的质量比对反应速率的影响。
编号 | 温度 | 催化剂 | 氯酸钾、二氧化锰的质量比 | 生成1升氧气所需时间/s |
实验Ⅰ | 400℃ | MnO2 | 1:1 | 153 |
实验Ⅱ | 400℃ | MnO2 | 2:1 | 240 |
小芳在实验时,误把氧化铜当作二氧化锰放入加热,结果发现也能较快产生氧气,于是进行如下探究:
猜想Ⅰ:除二氧化锰、氧化铜外,氧化铁(Fe2O3)也可以作氯酸钾分解的催化剂。
(设计实验)按下表进行实验,并测定开始产生气体时的温度(提示:开始产生气体的温度越低,表示反应速度越快)。
实验编号 | 实验药品 | 分解温度(℃) |
① | 氯酸钾 | 580 |
② | 氯酸钾和二氧化锰(质量比1︰1) | 350 |
③ | 氯酸钾和氧化铜(质量比1︰1) | 370 |
④ | 氯酸钾和氧化铁(质量比1︰1) | 390 |
(数据和结论)
(1)由实验_______与实验④对比,证明猜想合理;
(2)实验所用的三种物质中,催化效果最好的是_______。
(反思)
若要证明氧化铁是该反应的催化剂,还需验证它在化学反应前后的________和_______是否改变。
猜想Ⅱ:过氧化钙与水反应可制取氧气。
实验装置 | 实验主要过程 |
| ①检查装置气密性。 ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出。 |
实验结论:过氧化钙与水反应可制取氧气。
(分析与反思)
同学们对过氧化钙与水反应的生成物猜想如下:①氢氧化钙和氧气②碳酸钙和氧气
你认为猜想______(填序号)一定是错误的,理由是________,过氧化钙与水反应虽然没有快速收集到大量氧气,但过氧化钙在水中持续、缓慢放出氧气,因此小林认为渔民用过氧化钙做增氧剂。写出此反应的符号表达式________。
(计算)
该兴趣小组的同学们购得用于增氧的过氧化钙产品(杂质不含钙元素),标签如图所示。试计算:

(1)过氧化钙的相对分子质量为_______
(2)该产品中过氧化钙的质量分数至少为______。
(3)小组同学将3g某物质在制得的足量氧气中充分燃烧生成4.4g二氧化碳和1.8g水,求该物质中各元素的原子个数比(写出计算过程)。______
【题目】某化学课堂上同学们正在进行酸、碱、盐知识的探究,以下是教学片断,请你参与其中并认真填写空格.
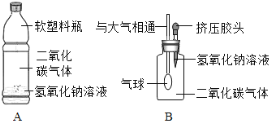
(学生实验)将二氧化碳分别通入澄清石灰水和氢氧化钠溶液中,观察到前者变浑浊,后者无明显现象.
(提出问题)二氧化碳通入氢氧化钠溶液中无明显现象,两者是否发生了化学反应?
(猜想假设)猜想①:两者发生了化学反应;猜想②:两者没有发生化学反应。
(实验探究)(1)小华设计了如图所示的A、B两个实验,实验现象:A中_______________,B中_______________。
(2)小红认为小华的实验是可行的,其共同原理是二氧化碳和氢氧化钠溶液反应,使容器内压强降低,小明同学却对此提出质疑,他认为小华的实验不严谨,其理由是________________ .要得到科学严谨的结论,如果利用B装置,应补充做的实验是____________,如果观察到_______________,则证明猜想①成立。
(3)小宁设计的是通过检验生成物来验证猜想,请你帮她填写实验报告.
实验步骤 | 实验现象 | 实验结论 |
向B实验后的溶液加入_________. | _________________ | 猜想①成立,相关化学方程式________________. |
(反思拓展)(1)氢氧化钠溶液必须密封保存,原因是(方程式)__________________。
(2)通过同学们的探究,我们发现,对于没有明显现象的化学反应,可以从两个不同的角度证明:______________________ ; ______________________。