��Ŀ����
����Ŀ����20����ѧϰ��ѧһ���ͬѧ�ǶԿα��ϡ���Խ�ǿ�Ľ���һ����Խ�λ�������Ľ��������ǵ�����Һ���û��������Լ���֧��ȼ�յ�����һ���������������仰���������ɡ�����ʦ�İ����£��ý�������̽���������⣺
�����������1���������ܷ��û�������ͭ��Һ�е�ͭ��
2���������ܷ��������������磺CO2����ȼ�գ�
���������ϡ�����Na���ʻ��ã������£���������������Ӧ���ɰ�ɫ���������ƣ�����������ˮ�����������ơ������ƻ�������ˮ���ҷ�Ӧ�ų�������
��ʵ��̽����
ʵ��һ������ʵ�����У������Ʊ�����ú���У�
�������Ӵ�ú����ȡ��һС������ƣ�����ֽ���ɱ���ú�ͺ�Ͷ������ͭ��Һ�У��۲쵽��Һ�г�����ɫ��������û�к�ɫ������������
�۰��ղ���ڽ�������Ͷ��ˮ�У�����Ӧ������μӷ�̪��Һ��������Һ��졣
ʵ�������ȼ�յ���Ѹ������ʢ��CO2�ļ���ƿ�У��۲쵽����CO2�м���ȼ�գ���Ӧ����ȴ��ƿ�ڸ��ź�ɫ��������ճ���Ű�ɫ���ʡ�
���������ۡ�
��1�������Ʊ�����ú���е�ԭ���ǣ� ��
��2��������������д���ƿ�Ͷ��ˮ�з�����Ӧ�Ļ�ѧ����ʽ�� ����Ͷ������ͭ��Һ���ܵĻ�ѧ��Ӧ����ʽ ��������ͭ���ȷֽ������ͭ��ˮ������24.0gʣ�����������¼��ȣ����ֹ�������������2.4g���������ٸı䣬д���˹����п��ܷ�����Ӧ�Ļ�ѧ����ʽ ��
��3��ʵ��������ɵĺ�ɫ������ ������ɫ���ʿ�����ʲô�أ�
��ͬѧ��Χ�ư�ɫ���ʿ�����ʲô�������²��룺����Ϊ��ɫ�����������ƣ�����Ϊ��̼���ƣ�����Ϊ�������ƺ�̼���ƵĻ�������Ϊ���������ơ�
����Ϊ���IJ����Ǵ���ģ������� ��
�ڶ�ɫ������ʲô����ʵ����̽��������������£�
����1��ȡ����Ʒ�������Թ������������ˮ�������ˣ�����Һ�м�����ɫ��̪��Һ���۲쵽��Һ��ɺ�ɫ�����ۣ���ɫ������һ���������ơ�
����2��ȡ����Ʒ�������Թ���μ��������ᣬ��Һ��������ð�������ۣ���ɫ������һ���� ��
����3��ȡ����Ʒ�������Թ������������ˮ�������ˣ�����Һ�м�������� ��Һ����ѡ�Լ���A.ʯ��ˮB.�Ȼ�����Һ C.����ͭ��Һ��������������ְ�ɫ������Ȼ����ˣ�������Һ��μ���ɫ��̪��Һ��������������֡��� ���ڼס��ҡ�����ѡ���IJ��������
�������뷴˼��С��ͬѧ��Ϊʵ�鷽��1�ó��Ľ��۲���ȷ���������� ��
ʵ�����еĽ������Ż�ʱ���������� ��
����չӦ�á��ⶨʵ����ʹ�õı�����������Ϊ16����������ͼ1����ʵ������������
��1��Ϊ���ⶨ��������20%������������Һ100g�����Ʋ����У����ܽ� �ڼ��㣬���������� g ��װƿ������ǩ �ܳ�ȡ������������ȡˮ mL��ˮ���ܶ�Ϊ1g/mL��������ȷ��˳��Ϊ �����������
��������������Һʱ����Ҫ�IJ�����������Ͳ���ձ����ιܼ� ��
��2��С��ͬѧ���ձ��м�����õ�����������Һ20g������μ�������ᡣ��pH�ⶨ�Dzⶨ�μӹ�������Һ��pH��ͼ2Ϊ�ⶨ�Ǵ�ӡ���ĵμ��������������ҺpH�Ĺ�ϵͼ��
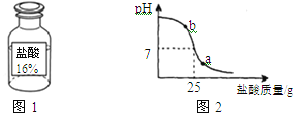
��a���Ӧ����Һ�� ������ԡ��������ԡ������ԡ�����b���Ӧ����Һ�е�����Ϊ ��д��ѧʽ����
�����Դ˴βⶨ�����ݣ���ʽ����������ʵ��������������2����
��3���������ʵ�������������ǩ�ϱ��������������һ�µĿ���ԭ�� ���������������
���𰸡����������ۡ���1����ֹ����������Ӧ����, ��2��2Na+2H2O==2NaOH+H2��
2Na+CuSO4 +2H2O==Cu��OH�� 2+Na2SO4+H2�� 4CuO��2Cu2O+O2��
��3��̼����C�� ����Ӧ����û����Ԫ�� ������2��̼��������Na2CO3�� ����3��B ��
��̼������ҺҲ�Ǽ��Ե� �û�ɳ�����
����չӦ�á���1��20 80 �ڢܢ٢� ������
��2�������� NaOH��NaCl ��14.6% ��3��������лӷ���
��������
������������������ۡ���1�����������ϵ���Ϣ�������Ʊ�����ú���е�ԭ���ǣ���ֹ����������Ӧ����
��2����������Ͷ��ˮ�У�����Ӧ������μӷ�̪��Һ��������Һ��죬˵������һ�ּ���ҽ����ƿ�����ˮ���ҷ�Ӧ�ų�������������ˮ��Ӧ�Ļ�ѧ����ʽ��2Na+2H2O==2NaOH+H2�����ʽ���Ͷ������ͭ��Һ�У����Ⱥ�ˮ��Ӧ�����ɵ�����������������ͭ��Һ��Ӧ�����ܵĻ�ѧ��Ӧ����ʽ��2Na+CuSO4 + 2H2O==Cu��OH�� 2+Na2SO4+H2����������24.0gʣ�����������¼��ȣ����ֹ�������������2.4g���������ٸı䣬˵������ͭ�ܹ������ֽ⣬���������غ㶨�ɣ�����ͭ�ֽ�ֻ���ܲ����������ʿ��ܷ�����Ӧ�Ļ�ѧ����ʽ��4CuO�� 2Cu2O+O2��
��3�����������غ㶨�ɣ�Ԫ�ص������ڷ�Ӧǰ�䣬��ʵ��������ɵĺ�ɫ������̼����C��
������Ϊ���������ƣ�������Ǵ���ģ�ԭ���ǣ���Ӧ����û����Ԫ�أ�
������2��ȡ����Ʒ�������Թ���μ��������ᣬ��Һ��������ð�������ۣ���ɫ������һ����̼��������Na2CO3��
����3��Ҫ֤��ԭ�������Ƿ��������ƣ�������Ϣ������������ˮ��Ӧ�����������ƣ���ֻ��֤���������������Ƽ��ɣ���Ҫ֤���������ƵĴ��ڣ�Ӧ�ȳ�ȥ̼���ƣ�������������Ȼ�����Һ��ѡB �����ܼ�A ʯ��ˮ����Ϊ��Ӧ�������������ƣ����Ƿ�����������Ƶ��жϻ��γɸ��ţ�����Ҳ���ܼ� C����ͭ��Һ����Ϊ�������ƻ�������ͭ��Ӧ
��С��ͬѧ��Ϊʵ�鷽��1�ó��Ľ��۲���ȷ���������ǣ�̼������ҺҲ�Ǽ��Ե� ����������ԭ���Լ���Ϣ����ʵ�����еĽ������Ż�ʱ�������������û�ɳ�����������𰸺���Ҳ������
����չӦ�á���1����������������������ı���ʽ������20%������������Һ100g����������������=20%��100g =20����ˮ������=100g-20g=80g����80 mL��������Һ�IJ���Ϊ�����㡢��������ȡ���ܽ⣬����ȷ��˳��Ϊ���ڢܢ٢ۣ���������������Һʱ����Ҫ�IJ�����������Ͳ���ձ����ιܼ�������
��2����a����Һ��PH<7���ʶ�Ӧ����Һ�����ԣ�b����Һ��PH>7��˵����Ӧ��������ʶ�Ӧ����Һ�е�����Ϊ��NaOH��NaCl
������ͼʾ����ҺPH=7ʱ����ʾ����ǡ����ȫ��Ӧ���������������Ϊ2g���ٸ��ݻ�ѧ����ʽ��NaOH + HCl = NaCl + H2O��NaOH��HCl��������ϵ���������
�⣺�����������������Ϊx
NaOH + HCl = NaCl + H2O
40 36.5
20g��20% 25g��x
40/36.5= 20g��20%/��25g��x��
x= 14.6%
�𣺴˴���������������Ϊ14.6��
��3���������ʵ�������������ǩ�ϱ��������������һ�µĿ���ԭ��������лӷ���

 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�