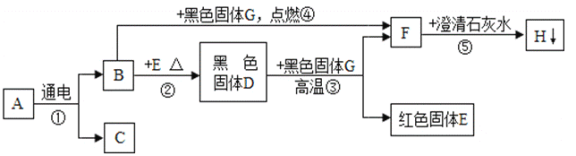
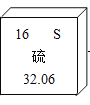
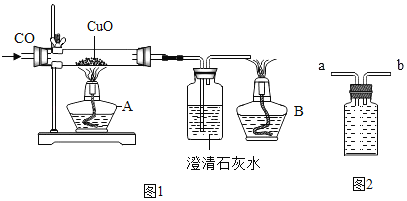
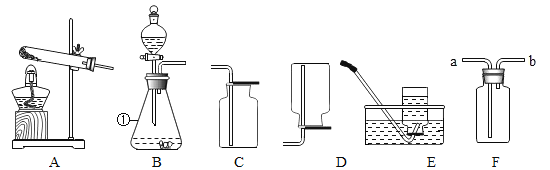
题目内容
【题目】有一研究性学习小组为测定某铜锌合金的成分,取10g该合金经粉碎后放入烧杯中,再加入足量的稀硫酸,反应过程中烧杯内固体物质的质量与反应时间的关系如图所示.请回答下列问题:
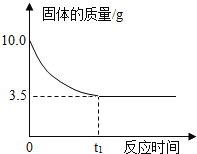
(1)将合金粉碎的目的是______.
(2)10g合金中铜的质量为______g.
(3)充分反应后产生的氢气质量______.
【答案】将合金粉碎的目的是使合金中的锌和稀硫酸充分反应. 3.5g; 0.2g;
【解析】
(1)将合金粉碎后,增大合金与硫酸反应的面积,使合金中的锌和稀硫酸充分反应;
(2)在铜锌合金中,铜与稀硫酸不反应,锌可与稀硫酸反应。从图中可知不能反应的固体的质量为3.5g,即合金中铜的质量;
(3)锌的质量为:10g-3.5g=6.5g
设生成氢气的质量为x。![]()
![]()
x=0.2g
答:充分反应后产生的氢气质量为0.2g。

练习册系列答案
相关题目