题目内容
【题目】化学小组为测定某石灰石样品中碳酸钙的质量分数,取12g样品加入到盛有100g稀盐酸的烧杯中,充分混合,经测定两种物质恰好完全反应(设样品中的其他物质不与稀盐酸反应)、烧杯内剩余物质的总质量为107.6g。求:
(1)样品中碳酸钙的质量分数是______?(计算结果精确到01%)
(2)所用稀盐酸的溶质质量分数是_____?
【答案】83.3% 7.3%
【解析】
解:根据质量守恒定律,二氧化碳的质量为:100g+12g﹣107.6g=4.4g;
设该石灰石样品中碳酸钙的质量分数为x,稀盐酸中溶质的质量分数为y
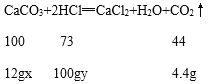
![]() =
=![]() =
=![]()
x≈83.3%
y=7.3%
答:(1)样品中碳酸钙的质量分数是83.3%;
(2)所用稀盐酸的溶质质量分数是7.3%。

练习册系列答案
相关题目